多组学项目文章 | Adv Sci:Ythdc1-p300-Klf5复合物介导的高尔基体功能障碍促进主动脉瘤进展
血管平滑肌细胞(VSMC)的稳态维持对于主动脉壁的结构完整性至关重要,而病理刺激诱导的VSMC过度凋亡是导致血管壁薄弱及主动脉瘤或主动脉夹层发生的关键因素。尽管机体存在凋亡诱导增殖(AIP)机制,即凋亡细胞能释放信号刺激邻近细胞增殖以补偿组织丢失,但该机制在主动脉病理重塑中的具体作用及分子调控网络尚不明确。转录因子Klf5已被证实是血管重塑的核心调节因子,且在动脉瘤中显著上调;同时,高尔基体作为细胞信号枢纽,其形态变化与细胞应激密切相关,并受Golph3l等蛋白调控。然而,目前尚缺乏证据将Klf5驱动的转录调控、Golph3l介导的高尔基体形态改变以及AIP效应在动脉瘤发病机制中进行有机串联。

2025年11月29日,河北医科大学温进坤/马冬/郑斌团队在《Advanced Science》期刊发表了题为”Ythdc1-p300-Klf5 Complex-Mediated Golgi Dysfunction Promotes Aortic Aneurys”的研究论文。该研究阐明了血管平滑肌细胞中凋亡诱导增殖效应促进主动脉瘤(AD/AAA)发展的分子机制。研究发现,AngII刺激导致lncRNA Gm40097的m6A修饰水平升高,通过招募阅读蛋白Ythdc1并促进其与p300及转录因子Klf5形成复合物,重塑染色质状态以激活Golph3l转录。Golph3l的高表达诱导高尔基体紧缩,促进TNF-α等炎性因子分泌,进而驱动疾病进展。此外,研究构建了基于临床特征和功能性SNP的术后死亡风险预测模型。
技术路线
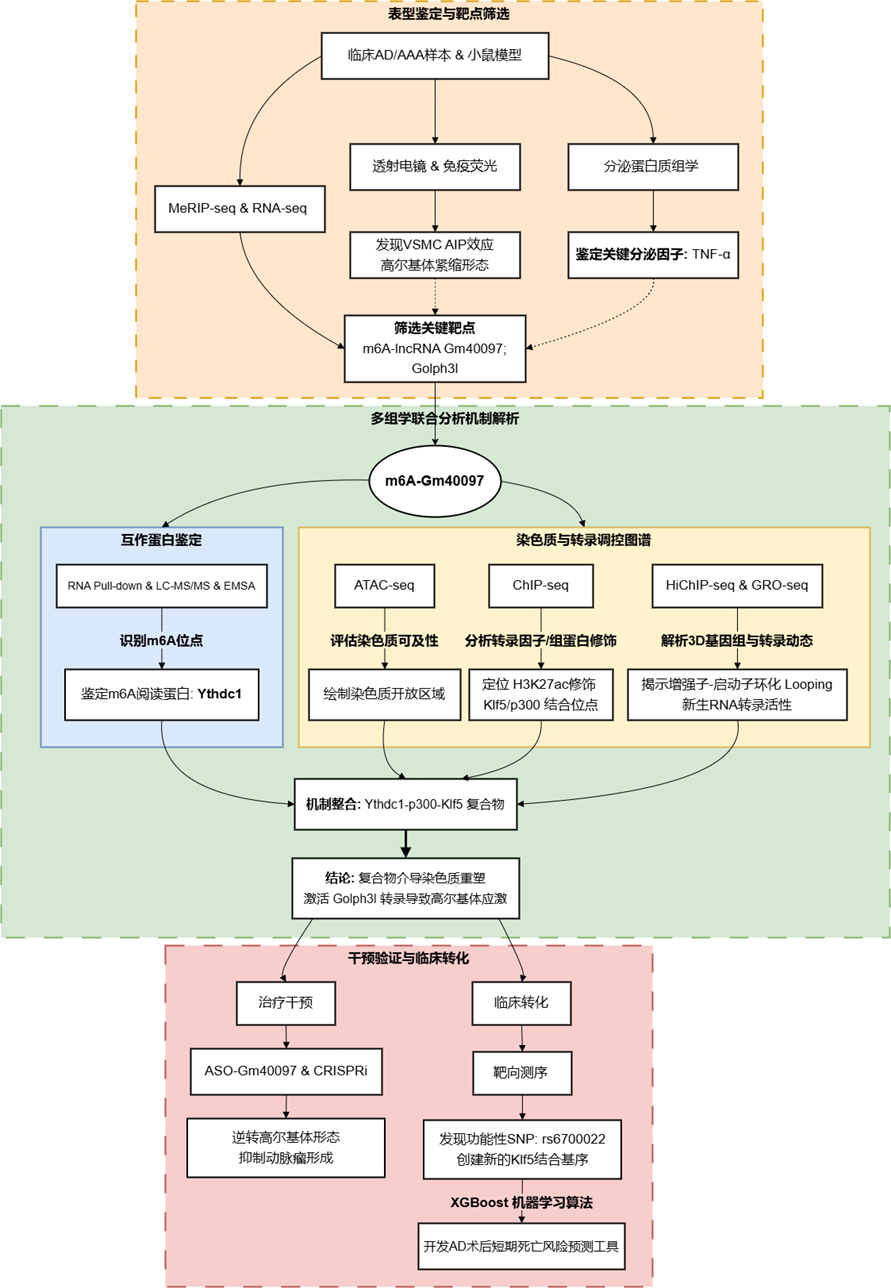
关键研究结果
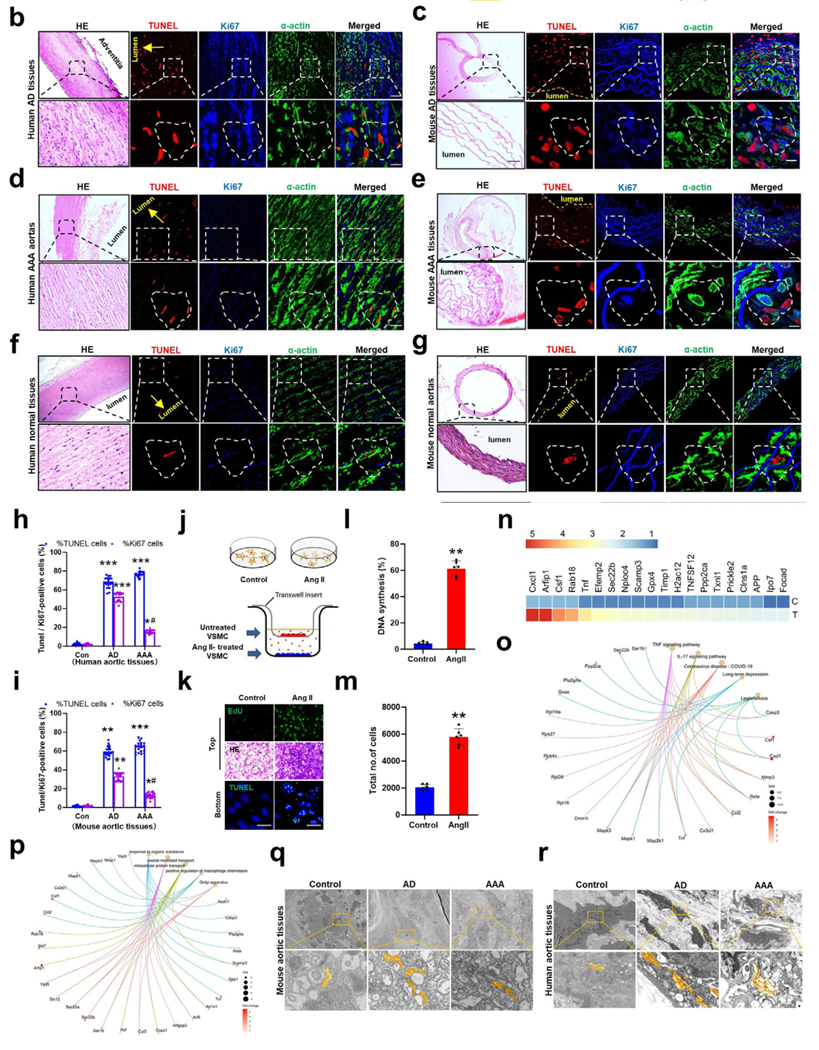
血管平滑肌细胞中AIP效应伴随高尔基体紧缩,Golph3l的上调是驱动该病理过程的核心
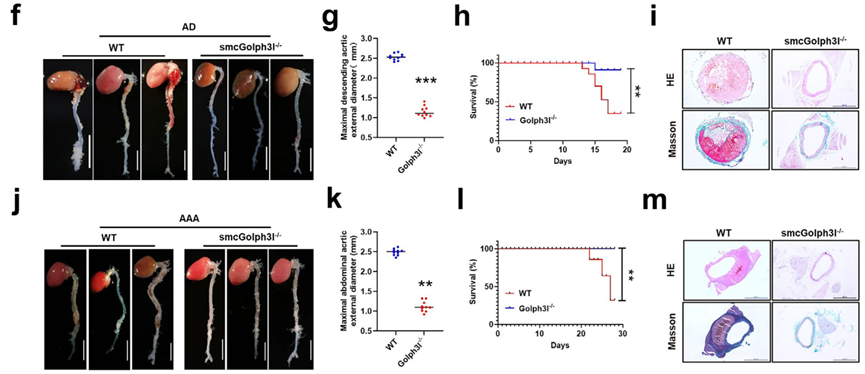
研究首先在人类和小鼠的主动脉瘤组织中证实了凋亡诱导增殖现象的发生,即凋亡的血管平滑肌细胞刺激邻近细胞的异常增殖。通过分泌蛋白质组学分析,锁定TNF-α是介导这一效应的关键分泌因子。超微结构观察发现,病变组织VSMC中的高尔基体呈现显著的致密紧缩状态。机制研究表明,高尔基体膜蛋白Golph3l的表达上调是导致高尔基体紧缩及随后的TNF-α分泌所必需的;特异性敲除VSMC中的Golph3l可阻断AIP效应并抑制动脉瘤形成。
AngII诱导的m6A修饰lncRNAGm40097作为增强子RNA,通过招募Ythdc1调控Golph3l
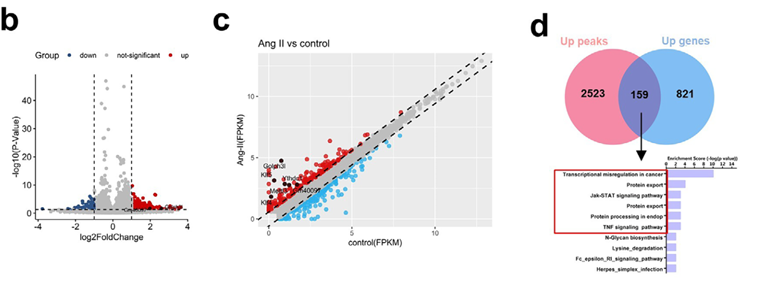
为解析Golph3l异常上调的上游机制,研究发现AngII刺激导致VSMC中整体m6A水平升高。通过多组学联合分析,鉴定出转录自Golph3l邻近区域的lncRNA Gm40097发生高水平m6A修饰且表达量显著增加。Gm40097作为一种seRNA,其功能依赖于m6A修饰。实验证实,Gm40097通过m6A位点招募阅读蛋白Ythdc1,从而维持Golph3l的高表达及高尔基体异常形态。
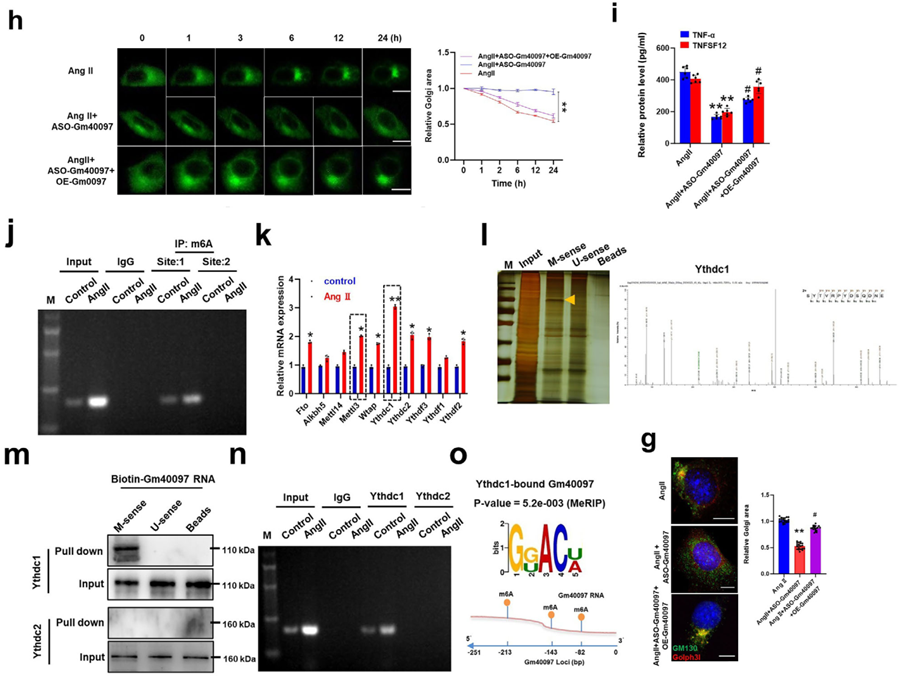
Ythdc1-p300-Klf5复合物介导染色质重塑及增强子-启动子环化,激活Golph3l转录
深入的机制研究揭示了一个精细的转录调控网络:m6A-Gm40097招募Ythdc1后,进一步促进转录因子Klf5与组蛋白乙酰转移酶p300的结合,形成Ythdc1-p300-Klf5转录复合物。该复合物结合于Golph3l启动子及Gm40097增强子区域,显著提高了染色质开放性和H3K27ac修饰水平,驱动增强子与启动子之间的长程互作,从而启动基因转录。
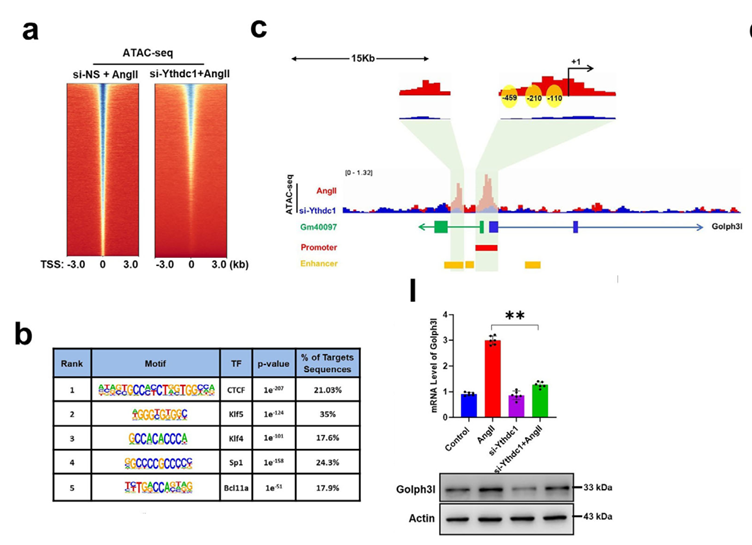
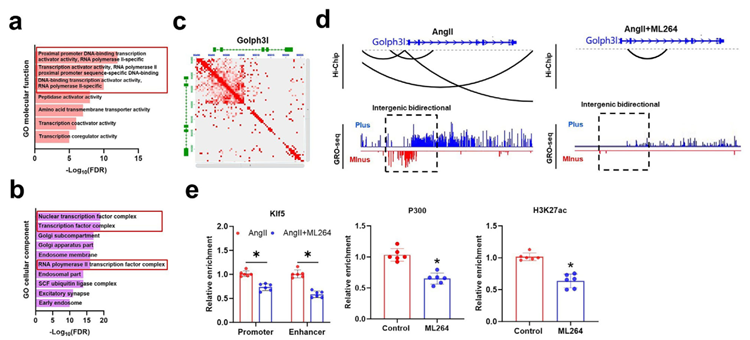
靶向Gm40097的治疗潜力及功能性SNP rs6700022的临床预测价值
在转化医学层面,研究验证了靶向Gm40097的ASO疗法在小鼠模型中的有效性。同时,在人类AD/AAA患者中鉴定出位于Golph3l上游的功能性SNPrs6700022(A>C)。该突变位点通过创建一个新的Klf5结合基序,模拟了增强子过度激活效应,导致Golph3l高表达。基于此遗传特征与临床指标,研究构建了机器学习模型以辅助预后评估。
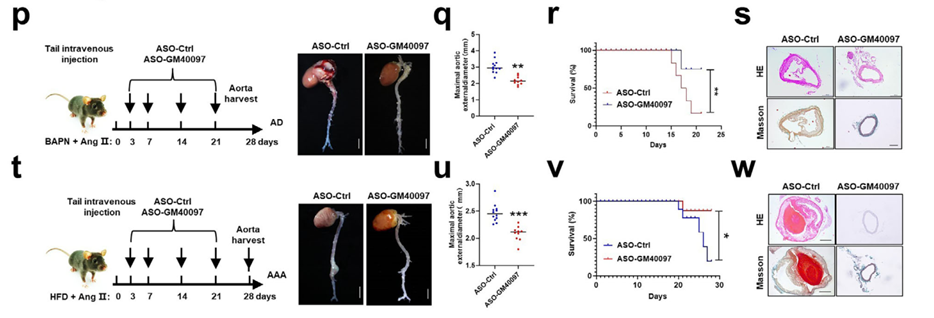
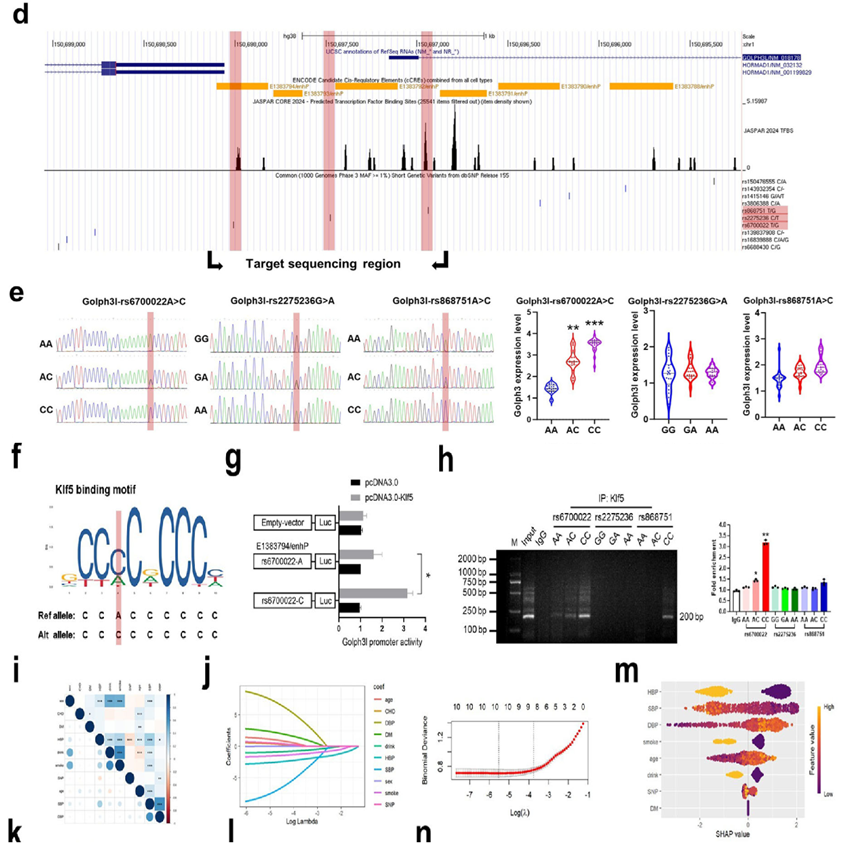
图8. d-g)序列分析与荧光素酶报告基因实验证实,rs6700022的C等位基因变异创造了一个新的Klf5结合位点,显著增强了启动子活性;ChIP实验进一步确认该位点在患者组织中富集Klf5结合;k-m)基于XGBoost算法,整合rs6700022基因型与多项临床指标(如肌酐激酶同工酶等)构建了AD术后短期死亡风险预测模型,在验证队列中表现优异(AUC=0.891),并提供了SHAP分析以解释各特征的贡献度
总结
该研究提出了“lncRNA m6A修饰—染色质重塑—高尔基体应激”驱动血管重构的新模型:在AngII等病理刺激下,VSMC中lncRNAGm40097发生m6A高甲基化,作为分子支架招募阅读蛋白Ythdc1。Ythdc1进一步募集组蛋白乙酰转移酶p300和转录因子Klf5,在Golph3l启动子处形成转录激活复合物,通过增加H3K27ac修饰和染色质开放性促进Golph3l转录。Golph3l的过量积累导致高尔基体紧缩,引发TNF-α等促炎因子的异常分泌,驱动了适应不良的AIP效应,最终导致主动脉壁结构破坏和动脉瘤形成。该研究不仅揭示了m6A修饰调控染色质状态的新机制,还发现了功能性SNPrs6700022作为潜在的遗传标记,并开发了ASO-Gm40097作为干预策略,具有重要的临床转化价值。
- - - 推荐阅读 - - -

m7G项目文章 | IF 20.6 中大附一团队揭示METTL1介导m7G修饰通过CTSB促进类风湿关节炎滑膜侵袭的分子机制
该研究首次揭示类风湿关节炎患者滑膜中METTL1表达升高,通过介导CTSB(组织蛋白酶B)mRNA内部m7G甲基化修饰增强其翻译效率,进而促进滑膜成纤维样细胞迁移和侵袭能力,驱动关节破坏
2025-12-11

MeRIP-seq项目文章 | FTO驱动狼疮致病B细胞形成(IF 14.6)、胰腺癌疼痛抑郁共病表观新机制(IF 15.0)
我们精选两篇近期客户发表的高分文章,分别是从METTL14和FTO切入的,下面就看下这两篇文章都做了什么,发现什么:
2025-12-11

客户成果刊登Nature | 北大伊成器/陈鹏团队合作开发全新RNA密码子扩展策略
2025-08-08
