MeRIP-seq项目文章 | FTO驱动狼疮致病B细胞形成(IF 14.6)、胰腺癌疼痛抑郁共病表观新机制(IF 15.0)
m6A是真核生物mRNA中最丰富且保守的修饰形式,广泛参与RNA剪接、转运、降解及翻译调控,是发育、肿瘤、免疫及神经科学等领域的核心因子。最近两年,m6A研究在机制、疾病应用和技术方法上依然均取得了重要进展。在基础机制方面,一项发表于《Cell》的研究揭示了m6A通过诱导核糖体停滞和碰撞来启动mRNA降解的全新原理,颠覆了传统的认知[1]。在疾病机制与治疗应用上,研究重点揭示了m6A调控“铁死亡”在卵巢癌、骨关节炎等疾病中的关键作用,并明确了靶向METTL3等writer酶在乳腺癌(尤其是三阴性乳腺癌)中的治疗潜力[2]。
我们精选两篇近期客户发表的高分文章,分别是从METTL14和FTO切入的,下面就看下这两篇文章都做了什么,发现什么:
文章一:FTO驱动狼疮致病B细胞形成(IF 14.6)

系统性红斑狼疮(SLE)是一种自身免疫性疾病,滤泡外年龄相关B细胞(ABC)的过度扩增和自身抗体产生是其关键病理特征。尽管已知Toll样受体7(TLR7)信号通路的过度激活在ABC形成中起重要作用,但其下游具体的表观转录组学与代谢重编程机制仍未完全阐明。

2025年11月5日,南方医科大学/广东省人民医院李洋、李鑫和曾琴团队在《Science Translational Medicine》期刊发表了题为“The m6A demethylase FTO links TLR7 to mitochondrial oxidation driving age-associated B cell formation in systemic lupus erythematosus”的研究论文[3]。该研究首次揭示了m6A去甲基化酶FTO作为关键节点,连接TLR7信号与线粒体氧化功能,通过稳定ATP6V1G1 mRNA表达维持溶酶体功能和线粒体稳态,从而驱动SLE中ABC的致病性分化。
技术路线/研究思路
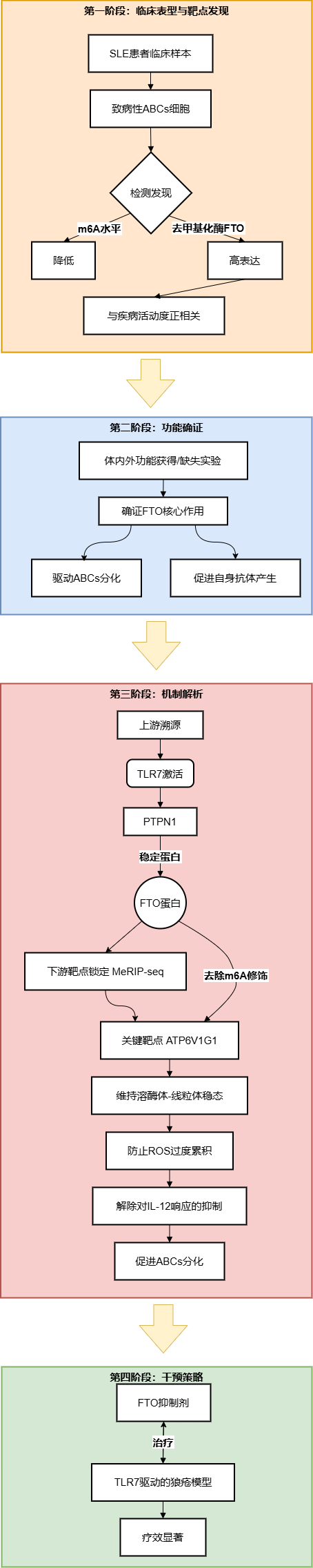
关键研究结果
作者首先分析发现,SLE患者B细胞中m6A修饰水平降低,而去甲基化酶FTO表达显著升高。FTO在ABC中特异性高表达,且与SLE疾病活动度及狼疮肾炎的免疫损伤程度呈正相关。
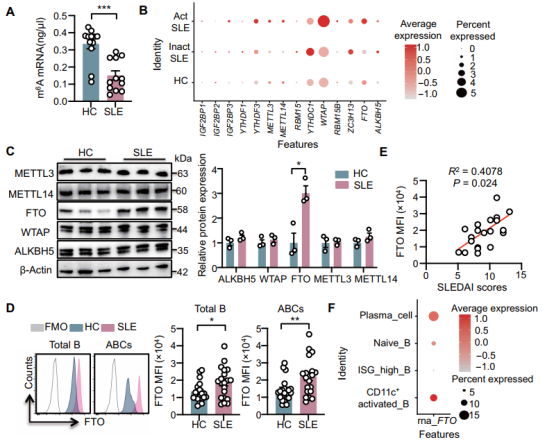
为明确功能,作者在体外人B细胞中过表达FTO,发现其促进了ABC分化及浆细胞形成;在红斑狼疮易感小鼠的B细胞中特异性过表达FTO,则加剧了自身抗体产生和肾脏损伤。相反,利用小分子抑制剂Dac51抑制FTO,或在B细胞中特异性敲除FTO,均能显著减少ABC形成,降低抗体滴度并减轻肾炎病理。这证明FTO是驱动ABC分化和SLE进展的关键因子。
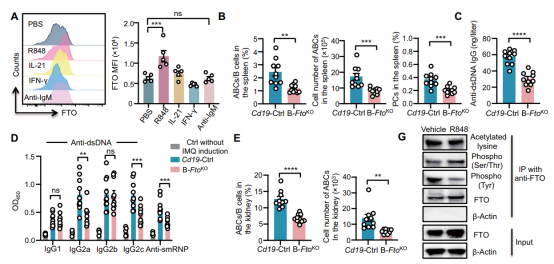
在机制层面,研究发现TLR7激活通过诱导酪氨酸磷酸酶PTPN1表达,促进FTO去磷酸化并稳定其蛋白水平。接着,利用meRIP-seq技术(由表观生物提供),作者成功鉴定出ATP6V1G1是FTO的关键下游靶点。FTO通过去除ATP6V1G1 mRNA上的m6A修饰,增加了其mRNA稳定性及蛋白表达。
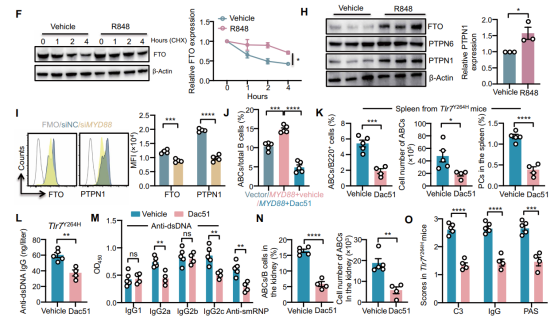
作者进一步揭示了FTO-ATP6V1G1轴调控ABC分化的代谢机制。FTO或ATP6V1G1的缺失导致溶酶体酸化障碍,阻碍了自噬流,进而导致受损线粒体的累积。这种线粒体功能障碍引起氧化磷酸化受损和活性氧水平升高。活性氧的累积通过氧化修饰抑制了B细胞对IL-12信号的响应,从而阻断了ABC的分化。使用线粒体抗氧化剂MitoTEMPO可恢复FTO缺陷B细胞对IL-12的响应及分化能力。
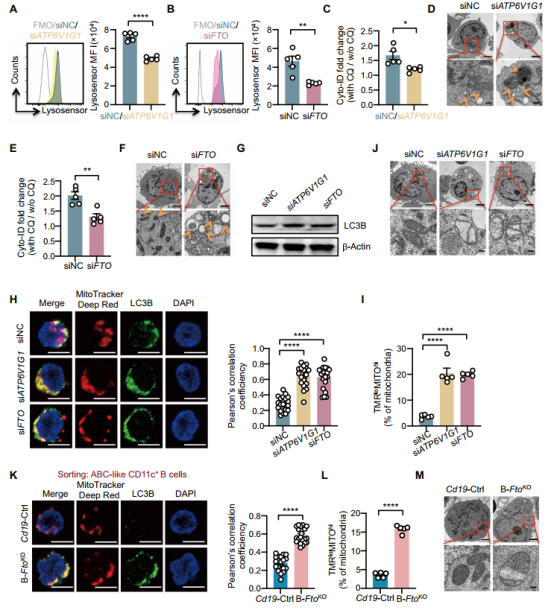
最后,作者探讨了靶向该通路的临床转化潜力。在TLR7功能获得性突变的小鼠模型中,使用FTO抑制剂Dac51治疗可显著减少ABC扩增、降低自身抗体并改善肾脏病理。这表明阻断TLR7-MyD88-FTO通路是治疗TLR7驱动的SLE亚型的潜在策略。
总结
综上,该研究揭示了TLR7-MyD88-FTO-ATP6V1G1这一全新的免疫-表观-代谢轴:TLR7激活稳定了FTO,FTO通过m6A去甲基化维持ATP6V1G1表达,进而保障溶酶体-线粒体质量控制,通过维持代谢适应性促进ABC的致病性分化。为理解SLE的异质性发病机制提供了新视角,并提示FTO抑制剂可能作为TLR7高活化型SLE患者的精准治疗药物。
作者信息
广东省人民医院李洋教授、李鑫教授、林浩博教授及为该论文的共同通讯作者。曾琴、李林及李雪为论文共同第一作者。研究由国家自然科学基金项目[82271822(李洋);82402089(曾琴);32200721(李鑫);82471815(朱云峰)]、优秀青年科学基金项目(海外)F124QT0100(李鑫)以及国家博士后创新人才支持计划BX20230097(曾琴)资助。
文章二:胰腺癌疼痛抑郁共病表观新机制(IF 15.0)

胰腺导管腺癌(PDAC)患者常饱受顽固性神经病理性疼痛与严重抑郁情绪的折磨。这种共病状态极大地削弱了患者的生存质量。尽管已知肿瘤能与神经系统双向通讯,但外周肿瘤如何重塑中枢神经环路诱发共病,其机制一直未明。
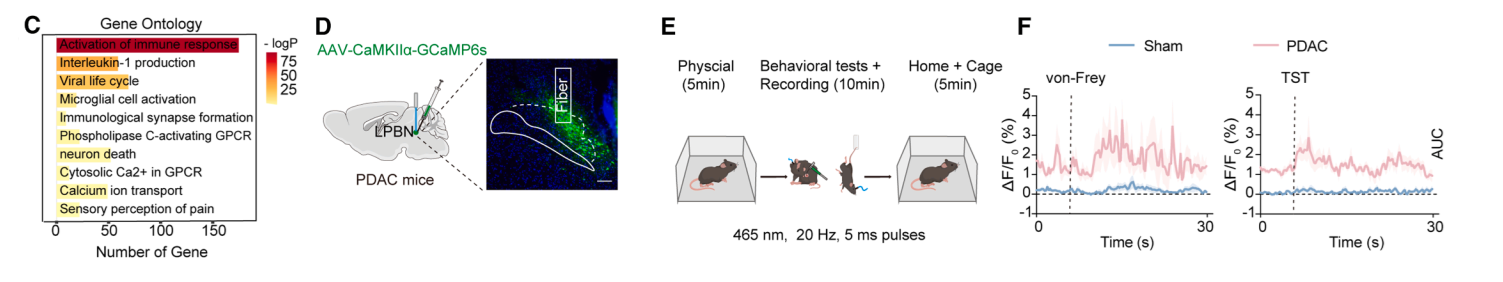
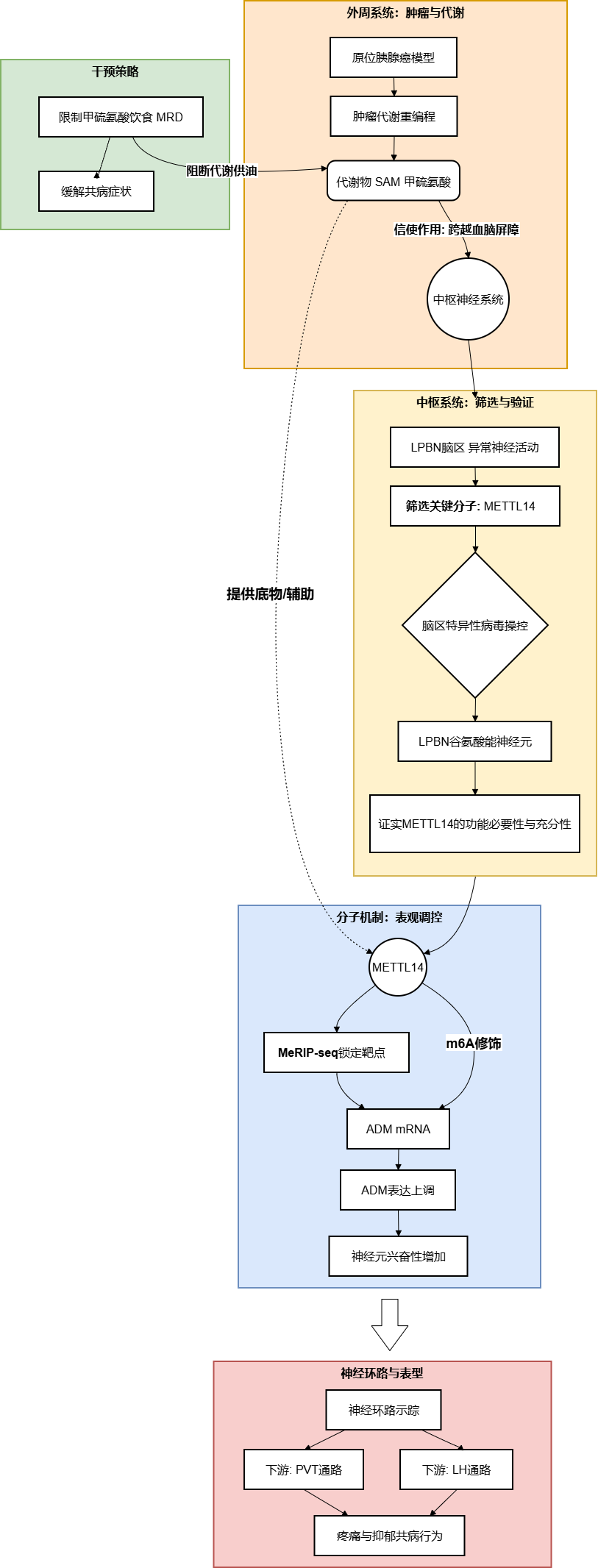
2025年11月4日,中山大学肿瘤防治中心谢敬敦教授团队在国际顶尖神经科学期刊《Neuron》发表研究,题为“METTL14 integrates tumor-derived SAM to drive parabrachial epigenetic rewiring in pancreatic cancer”。该研究创新性地提出了一条“代谢-表观-神经”跨系统调控轴:胰腺肿瘤来源的S-腺苷甲硫氨酸(SAM)作为关键代谢信号,被中枢外侧臂旁核(LPBN)利用,辅助METTL14介导的m6A修饰,导致神经元异常兴奋及特定环路重塑,最终引发癌症相关的疼痛与抑郁。
技术路线/研究思路
关键研究结果
研究建立了原位胰腺癌小鼠模型,重现了随肿瘤进展加剧的疼痛和抑郁行为。全脑筛选发现,LPBN区域兴奋性谷氨酸能神经元中METTL14呈现特异性上调,且其表达丰度与共病严重程度高度正相关,提示METTL14可能是共病发生的关键分子开关。
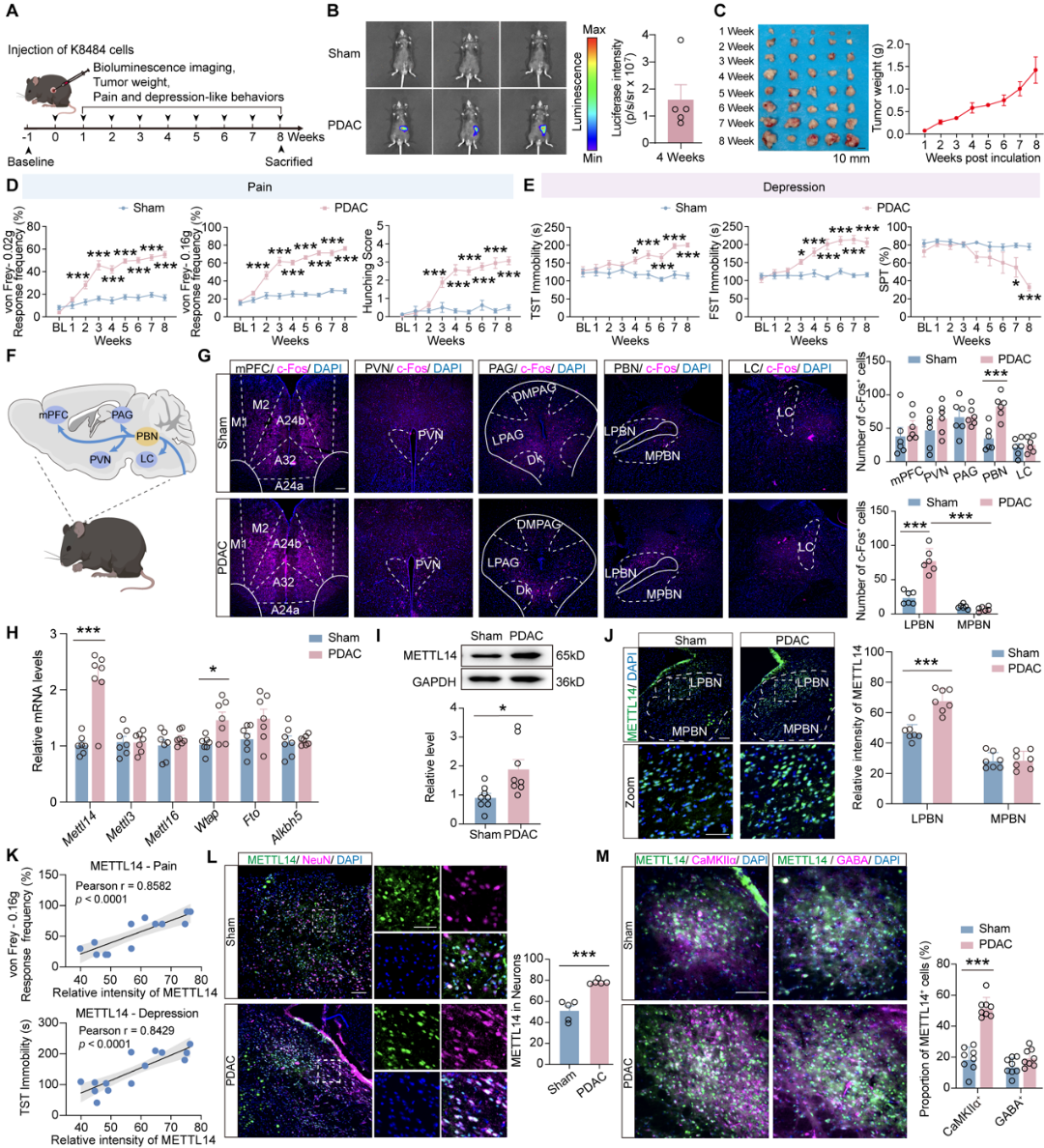
通过病毒载体技术对LPBN谷氨酸能神经元进行操控,结果表明:在荷瘤小鼠中特异性敲低或敲除METTL14,能显著缓解疼痛及抑郁状态;而在健康小鼠该脑区过表达METTL14,则足以诱发出类似癌症小鼠的共病表型。这证实LPBN中的METTL14是驱动PDAC疼痛-抑郁共病的核心分子。
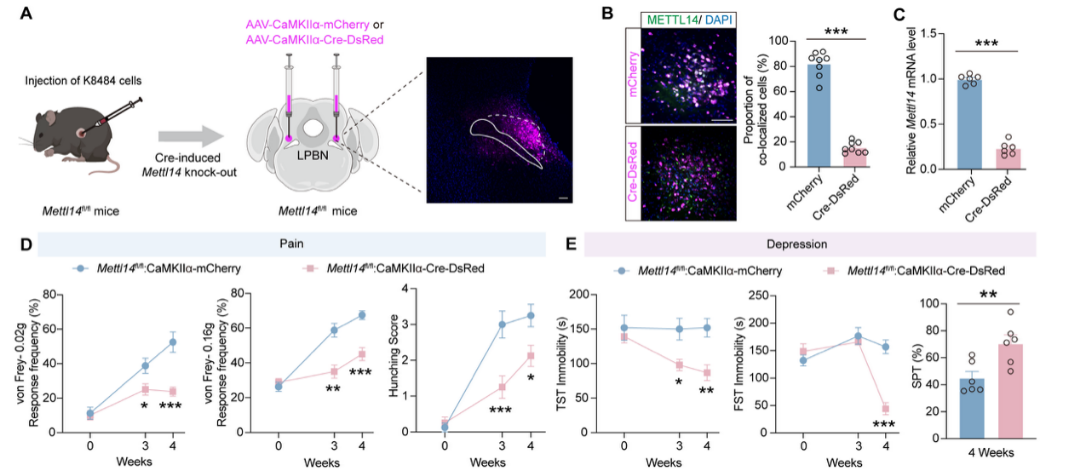
在分子机制探索中,作者通过meRIP-seq(由表观生物提供)锁定了神经肽肾上腺髓质素(ADM)为METTL14的关键下游靶点。解析发现,肿瘤分泌的大量SAM进入循环并渗透至中枢,为METTL14提供了充足甲基供体。METTL14进而催化ADM mRNA 3'UTR区域的m6A修饰,增强其转录稳定性及蛋白表达。电生理实验证实,ADM上调直接导致神经元兴奋性飙升。
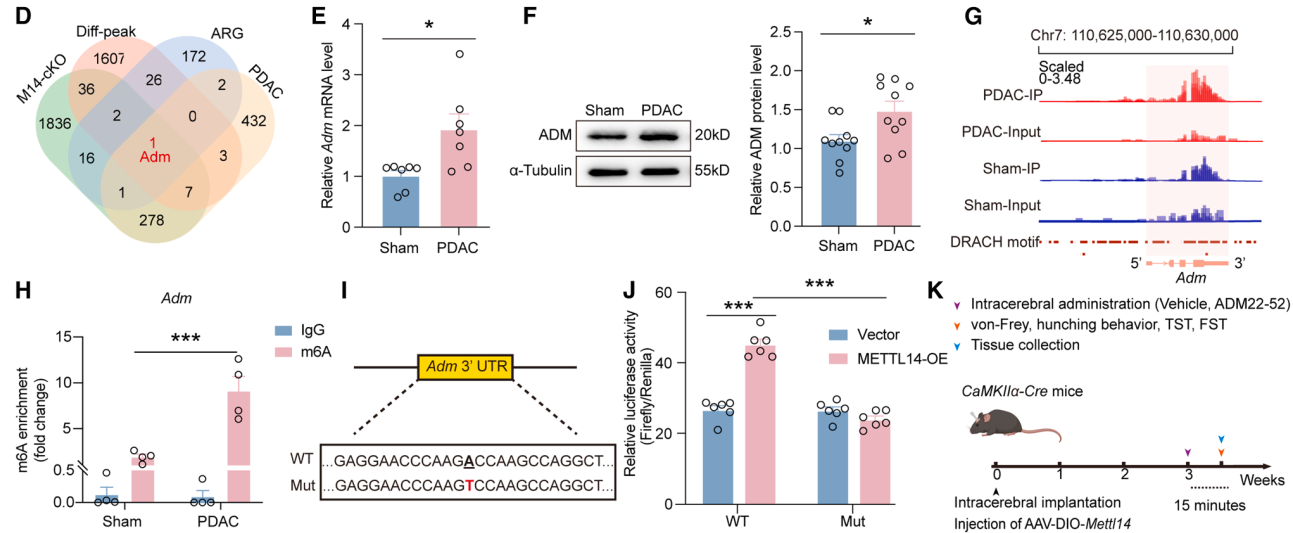
大脑如何将LPBN的异常信号转化为具体的行为输出?利用顺行跨单级病毒示踪技术,研究团队描绘了LPBN谷氨酸能神经元下游的两条关键投射路径:分别指向丘脑室旁核(PVT)和下丘脑外侧区(LH)。功能获得与缺失实验显示,特异性抑制LPBN→PVT或LPBN→LH环路的神经传导,均能显著改善PDAC小鼠的疼痛与抑郁症状,表明这两条平行通路共同构成了共病发生的神经解剖学基础
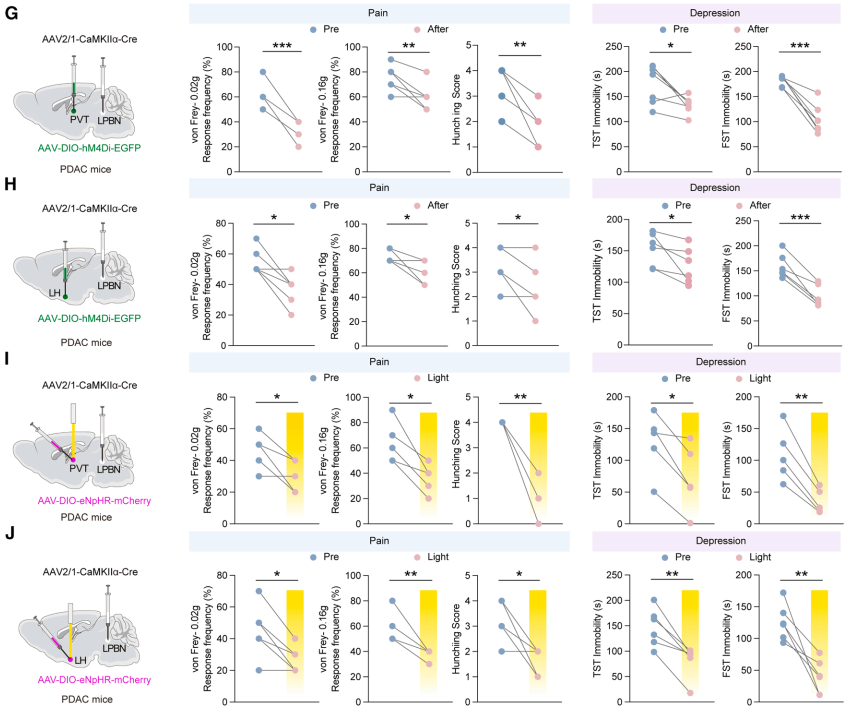
研究最后回归临床与干预策略。作者在PDAC患者队列中发现,血浆SAM浓度与患者的疼痛评分呈显著正相关,且小鼠模型中血浆SAM水平亦随肿瘤负荷增加而攀升。基于此,研究提出了一种非药物干预策略——甲硫氨酸限制饮食(MRD)。实验表明,MRD不仅能通过切断SAM的底物供应来降低循环SAM水平,从而缓解疼痛和抑郁,还能显著抑制原发肿瘤的生长,展现出作为PDAC综合治疗辅助手段的巨大潜力。
总结
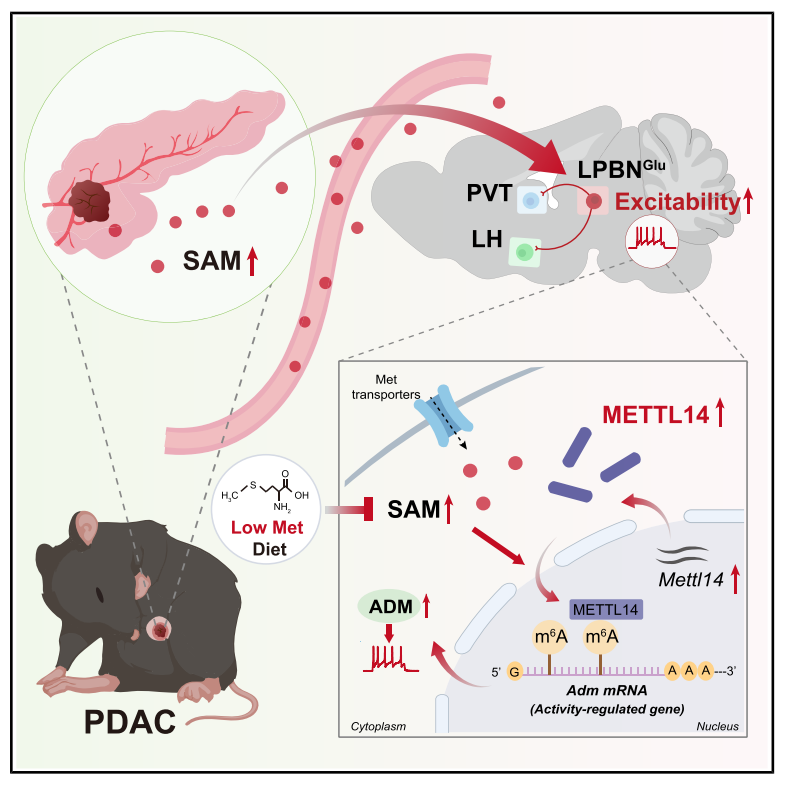
该研究通过精巧的实验设计,完整勾勒了从外周肿瘤代谢重编程到中枢神经表观遗传重塑的致病链条,不仅解析了METTL14-ADM轴及相关神经环路的作用,更为临床提供了一种低成本、易推广的饮食干预新思路,有望改善胰腺癌患者的生存质量。
作者信息:
中山大学肿瘤防治中心谢敬敦教授为该论文的独立通讯作者,杨晓华、王欣桐、陆伟成和叶青青为论文共同第一作者。研究得到国家自然科学基金、广东省基础与应用基础研究基金、以及中山大学肿瘤防治中心青年人才计划的大力支持。
参考文献:
[1] Murakami S, Olarerin-George AO, Liu JF, Zaccara S, Hawley B, Jaffrey SR. m6A alters ribosome dynamics to initiate mRNA degradation. Cell. 2025;188(14):3728-3743.e20.
[2] Harris AE, Lothion-Roy J, Thompson RL, et al. Functional and clinical significance of the RNA m6A methyltransferase complex in breast cancer. NPJ Breast Cancer. Published online November 27, 2025.
[3] Zeng Q, Li L, Li X, et al. The m6A demethylase FTO links TLR7 to mitochondrial oxidation driving age-associated B cell formation in systemic lupus erythematosus. Sci Transl Med. 2025;17(823):eadu6015.
[4] Yang X, Wang X, Lu W, et al. METTL14 integrates tumor-derived SAM to drive parabrachial epigenetic rewiring in pancreatic cancer. Neuron. Published online November 4, 2025.
- - - 推荐阅读 - - -

客户成果刊登Nature | 北大伊成器/陈鹏团队合作开发全新RNA密码子扩展策略
2025-08-08

客户文章 | CDD:NAT10通过ac4C修饰ETS2 mRNA驱动巨噬细胞炎症及心脏损伤新机制
NAT10(N-乙酰转移酶10)是目前已知的唯一真核生物ac4C writer(写入酶),它可以催化mRNA的ac4C修饰从而提高mRNA的稳定性和翻译效率 。然而,NAT10在巨噬细胞炎症激活中的具体功能,以及其如何通过ac4C修饰调控脓毒症引起的心脏损伤,仍有待深入探索。
2025-11-26

客户文章 | APSB (IF 14.6):暨南大学附一徐安定/逯丹教授团队在缺血半暗带治疗新靶点又一突破
2025-09-18
