客户文章 | CDD:NAT10通过ac4C修饰ETS2 mRNA驱动巨噬细胞炎症及心脏损伤新机制
论文索引
【DOI】10.1038/s41419-025-07796-6
【发表时间】2025年7月1日
【单位】复旦大学中山医院心内科葛均波院士团队
【关键词】NAT10;ac4C RNA修饰;巨噬细胞激活;炎症性心脏功能障碍;内毒素血症;USP39;ETS2
【表观生物提供】acRIP-seq、Ribo-seq
这项研究揭示了NAT10在LPS诱导的巨噬细胞激活和心脏功能障碍中的关键机制。研究团队发现,在内毒素血症模型中,去泛素化酶USP39通过稳定NAT10蛋白,使其在巨噬细胞中显著上调。高表达的NAT10通过ac4C修饰直接靶向转录因子Ets2的mRNA,增强其稳定性和翻译效率,从而驱动巨噬细胞的促炎表型。更为重要的是,特异性敲除髓系NAT10或使用小分子抑制剂Remodelin,可显著减轻炎症反应并改善小鼠的心脏功能,为治疗脓毒症相关心肌损伤提供了新的潜在靶点。
点击收听AI解读
1.LPS通过促进USP39介导的去泛素化修饰稳定NAT10蛋白
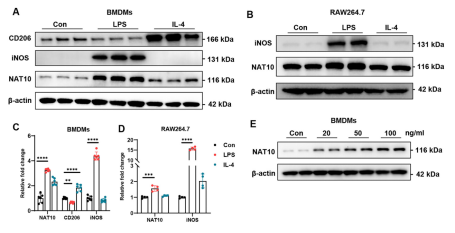
研究团队首先探究了炎症刺激对NAT10表达的影响。在骨髓来源巨噬细胞(BMDMs)和RAW264.7细胞中,利用脂多糖(LPS)或IL-4处理后发现,LPS刺激显著上调了NAT10的蛋白水平,且这种上调呈现出明显的时间依赖性和剂量依赖性。值得注意的是,尽管蛋白水平显著增加,但通过qPCR检测发现Nat10的mRNA水平在激活后并未发生显著变化,这提示NAT10的表达调控发生在转录后水平。
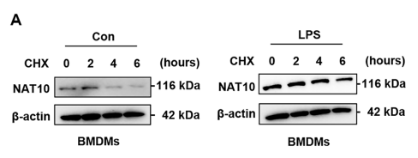
为了验证这一点,研究人员使用了蛋白合成抑制剂放线菌酮(CHX)进行追踪实验,结果显示在LPS刺激下,NAT10蛋白的半衰期显著延长,表明LPS通过抑制蛋白降解来稳定NAT10。
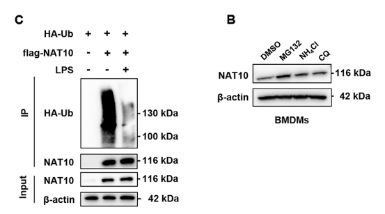
进一步的机制研究发现,NAT10的降解主要通过蛋白酶体途径进行,而非自噬或溶酶体途径。在LPS刺激下,NAT10的泛素化水平显著降低。

为了寻找调控这一过程的关键酶,研究团队利用IP-MS技术筛选了NAT10的互作蛋白,并在交集中鉴定出唯一候选的去泛素化酶USP39。
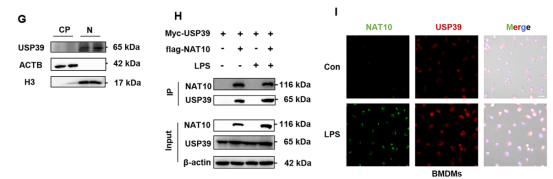
免疫荧光和Co-IP实验证实USP39与NAT10在细胞核内存在共定位和直接相互作用。功能验证实验表明,USP39通过特异性去除NAT10蛋白K498位点上的K48连接的多泛素链,从而阻断其蛋白酶体降解途径,维持其在炎症环境下的高水平表达。
2.NAT10缺失抑制巨噬细胞促炎激活并重塑ac4C修饰谱
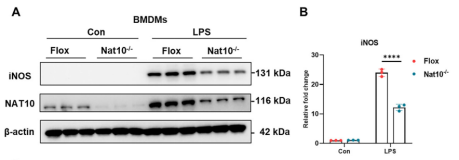
为了明确NAT10在巨噬细胞炎症反应中的具体功能,研究人员构建了髓系特异性Nat10敲除小鼠(Nat10-/-),并分离BMDMs进行体外实验。Western Blot和qPCR结果显示,与对照组(Flox)相比,LPS刺激下的Nat10-/-巨噬细胞中,M1型巨噬细胞标志物诱导型一氧化氮合酶(iNOS)的蛋白表达显著降低。
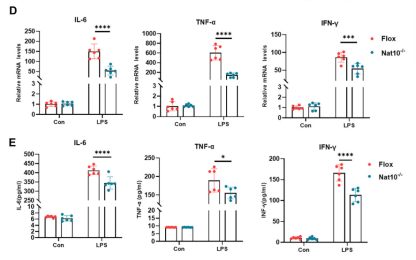
同时关键促炎细胞因子(如IL-6, TNF-α, IFN-γ)的mRNA转录水平和培养基中的分泌水平均大幅下降。
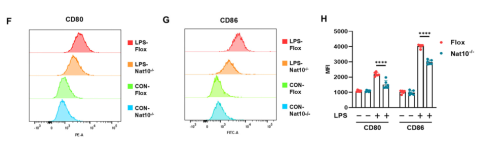
流式细胞术分析进一步证实,NAT10缺失导致巨噬细胞表面共刺激分子CD80和CD86的表达显著减少,表明巨噬细胞的促炎激活受到抑制。此外,使用NAT10的小分子抑制剂Remodelin处理也能在野生型细胞中产生类似的抗炎效果,验证了NAT10作为治疗靶点的潜力。

研究团队进一步通过acRIP-seq测序分析。结果显示,NAT10介导的ac4C修饰主要富集在mRNA的CDS区和3'UTR区,且识别基序符合经典的CXXCXX序列。
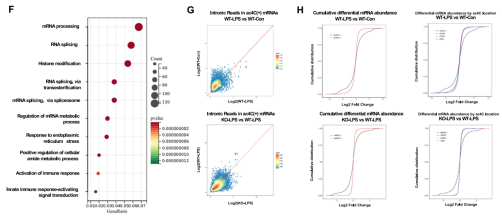
差异分析表明,NAT10敲除后,大量与炎症激活和RNA加工相关的转录本呈现低乙酰化状态。累积分布函数(CDF)分析揭示,NAT10并非通过改变整体mRNA的丰度,而是通过特异性调节关键基因的ac4C修饰水平来影响巨噬细胞的炎症表型,这为后续寻找特异性靶点提供了重要线索
3.NAT10通过ac4C修饰增强Ets2 mRNA的稳定性及翻译效率
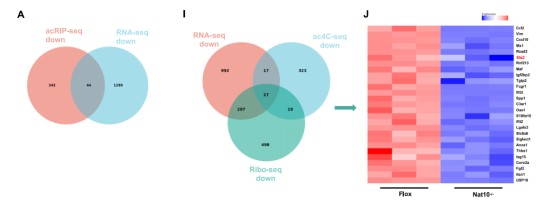
为了精准锁定NAT10调控的下游靶基因,研究人员联合分析了acRIP-seq、Ribo-seq和RNA-seq(由表观生物提供)的多组学数据。在三组数据的交集中,转录因子Ets2被鉴定为受NAT10直接调控的核心靶点。
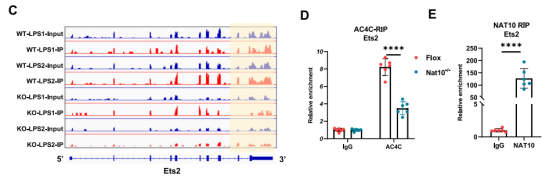
IGV可视化分析清晰地展示了NAT10敲除后Ets2 mRNA上的ac4C峰值显著降低,这一结果得到了ac4C-RIP-qPCR的验证。进一步的NAT10-RIP-qPCR和RNA pull-down实验证实,NAT10蛋白能够直接结合Ets2的mRNA转录本。
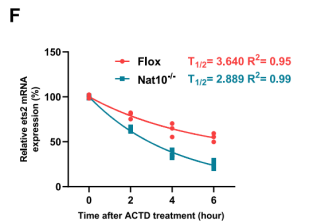
在机制层面,RNA稳定性实验表明,NAT10缺失导致Ets2 mRNA的半衰期显著缩短,说明ac4C修饰增加了其稳定性。
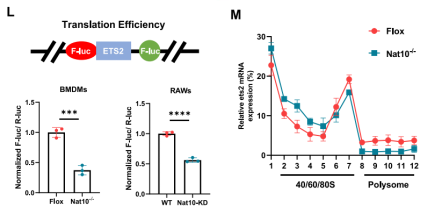
更关键的是,Polysome profiling(多核糖体分析)和双素荧光素酶报告基因实验显示,NAT10缺失导致Ets2 mRNA在多核糖体组分(翻译活跃区)中的分布显著减少,证明ac4C修饰对维持Ets2的高效翻译至关重要。
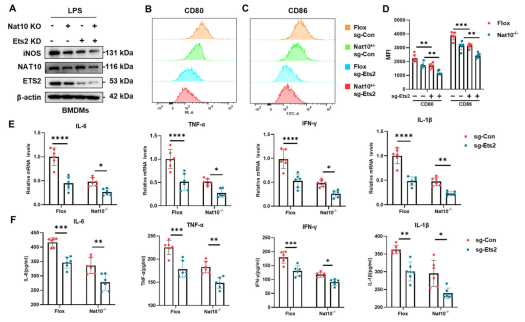
功能回复实验进一步确立了这一轴线的因果关系:在Nat10-/-巨噬细胞中通过慢病毒过表达Ets2,可以显著回补iNOS及促炎因子的表达水平,部分逆转NAT10缺失导致的抗炎表型。这些结果详尽地阐明了“NAT10-ac4C-Ets2”轴在驱动巨噬细胞炎症反应中的核心分子机制。
4.靶向NAT10显著改善内毒素血症诱导的心脏功能障碍

研究最后在LPS诱导的ETM小鼠模型中验证了NAT10的病理生理意义。实验结果显示,LPS攻击后,小鼠心脏组织中浸润的巨噬细胞内NAT10和Ets2的蛋白表达水平均显著上调。
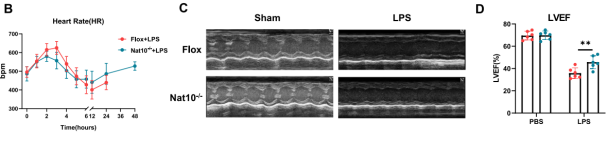
生存分析表明,髓系特异性Nat10敲除小鼠在LPS致死剂量攻击下的存活率显著高于对照组。
利用超声心动图对心功能进行评估,发现Nat10敲除显著改善了内毒素血症引起的心力衰竭症状,表现为左室射血分数(LVEF)、短轴缩短率(LVFS)和每搏输出量(LVSV)的显著回升,心率波动也更为平稳。
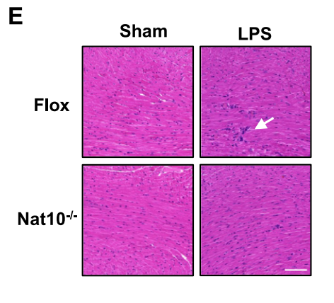
H&E染色结果显示,Nat10敲除组小鼠心肌组织中的细胞空泡化、白细胞浸润和间质水肿等病理改变明显减轻。
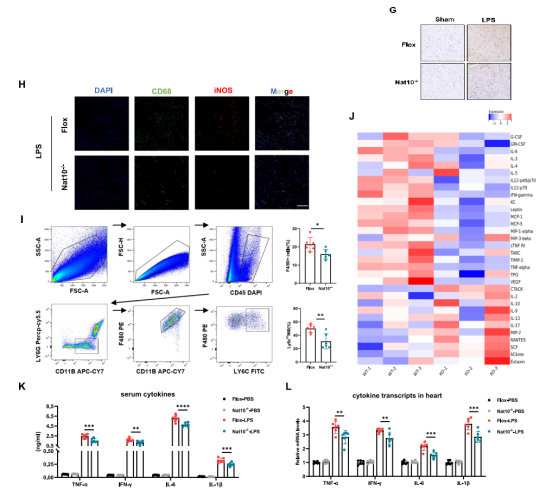
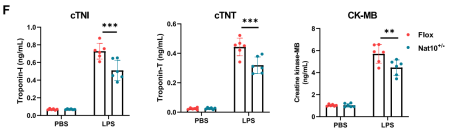
血清生化指标分析进一步证实,心肌损伤标志物肌钙蛋白T(cTnT)、肌钙蛋白I(cTnI)和肌酸激酶同工酶(CK-MB)的释放显著减少。此外,免疫组化和流式细胞术分析显示,心肌组织中CD68+iNOS+促炎巨噬细胞的浸润大幅减少,血清及心脏组织中的促炎因子(IL-6, TNF-α等)水平也显著降低。
同样地,预防性给予NAT10抑制剂Remodelin也能模拟基因敲除的保护作用,显著提高脓毒症小鼠的生存率并改善心脏功能。这些体内实验数据有力地证明了靶向NAT10是治疗脓毒症相关心肌功能障碍的有效策略。
该研究阐明了NAT10在巨噬细胞炎症激活和脓毒症心肌病中的转录后调控机制:在炎症刺激(LPS)下,去泛素化酶USP39与NAT10相互作用并去除其K48泛素链,导致NAT10蛋白积累;稳定的NAT10通过催化Ets2 mRNA的ac4C修饰,增强了Ets2的mRNA稳定性和翻译效率;上调的Ets2转录因子进一步驱动巨噬细胞的促炎程序,最终导致全身炎症和心肌损伤。这一发现不仅扩展了ac4C修饰在免疫调节中的功能认知,也为脓毒症心肌病的治疗提供了基于表观转录组学的潜在策略。
复旦大学附属中山医院肖子龙为共同第一作者。复旦大学附属中山医院宿燕岗教授、梁义秀教授为通讯作者。该研究由国家自然科学基金(No.82170386、No.82100370)资助。


