客户文章 | APSB (IF 14.6):暨南大学附一徐安定/逯丹教授团队在缺血半暗带治疗新靶点又一突破
缺血性卒中是全球致死和致残的主要原因,在急性期后减少神经元损伤的治疗选择有限。缺血半暗带是梗死核心周围功能受损但尚可挽救的组织区域,是治疗的关键,但目前针对半暗带的有效脑细胞保护策略仍匮乏。环状RNA(circRNA)是一类共价闭合的非编码RNA,在脑组织中广泛表达并参与神经稳态和疾病调控。暨南大学附属第一医院徐安定/逯丹教授团队前期报道了缺氧特异性CircOGDH主要表达在缺血半暗带神经元中,并介导神经元凋亡,其表达水平与缺血半暗带体积显著相关,是缺血半暗带预测和AIS治疗潜在的生物标志物,但其在缺血神经元中高表达的机制尚不明确。
N6-甲基腺苷(m6A)RNA修饰是RNA稳定性,转运和翻译的关键调节因子。在急性缺血性卒中期间,外周免疫细胞和缺氧神经元中的m6A甲基化水平升高,它们可能有助于暂时抑制翻译以保持细胞存活。与YTH结构域蛋白家族介导m6A依赖性RNA降解不同,胰岛素样生长因子2 mRNA结合蛋白(IGF2BPs)通过识别m6A位点以增强RNA稳定性。IGF2BP1有助于稳定应激响应的RNA并形成应激颗粒(SG),在细胞应激和缺血期间隔离关键mRNA。IGF2BP1还通过Ran-GTP和exportin-2依赖性机制参与circRNA的核输出。
基于此,近期,该团队联合中山大学麦鸿成教授团队(合作单位:中山大学孙逸仙纪念医院)在Acta Pharm Sin B(IF 14.6,中科院一区TOP期刊)杂志上在线发表了题为“IGF2BP1 positively regulates CircOGDH accumulation in hypoxia induced stress granules”的研究论文,动态揭示了缺氧条件下m6A修饰介导IGF2BP1调控CircOGDH的表达机制,解析了IGF2BP1通过在应激颗粒中结合m6A修饰的CircOGDH,正向调节CircOGDH表达,从而导致半暗带神经元损伤机制。并强调敲低IGF2BP1可降低CircOGDH表达,减少神经元凋亡,同时可显著改善突触完整性,双向保护神经元,改善梗死体积,提示其作为治疗靶点的优越性。

首先,该团队在小鼠急性卒中模型和神经细胞缺氧模型中发现半暗带神经元m6A修饰水平明显增加,说明高m6A修饰与半暗带病理有关。该团队前期报道CircOGDH是改善半暗带神经元存活的潜在治疗靶点。同样,缺氧也上调了SH-SY5Y神经元细胞中CircOGDH的表达。使用SRAMP软件预测CircOGDH有高置信度或中等置信度的2个m6A修饰预测位点,并且通过MeRIP证实CircOGDH在缺氧时存在明显的m6A修饰,提示半暗带神经元的病理过程与CircOGDH的m6A甲基化增加有关。
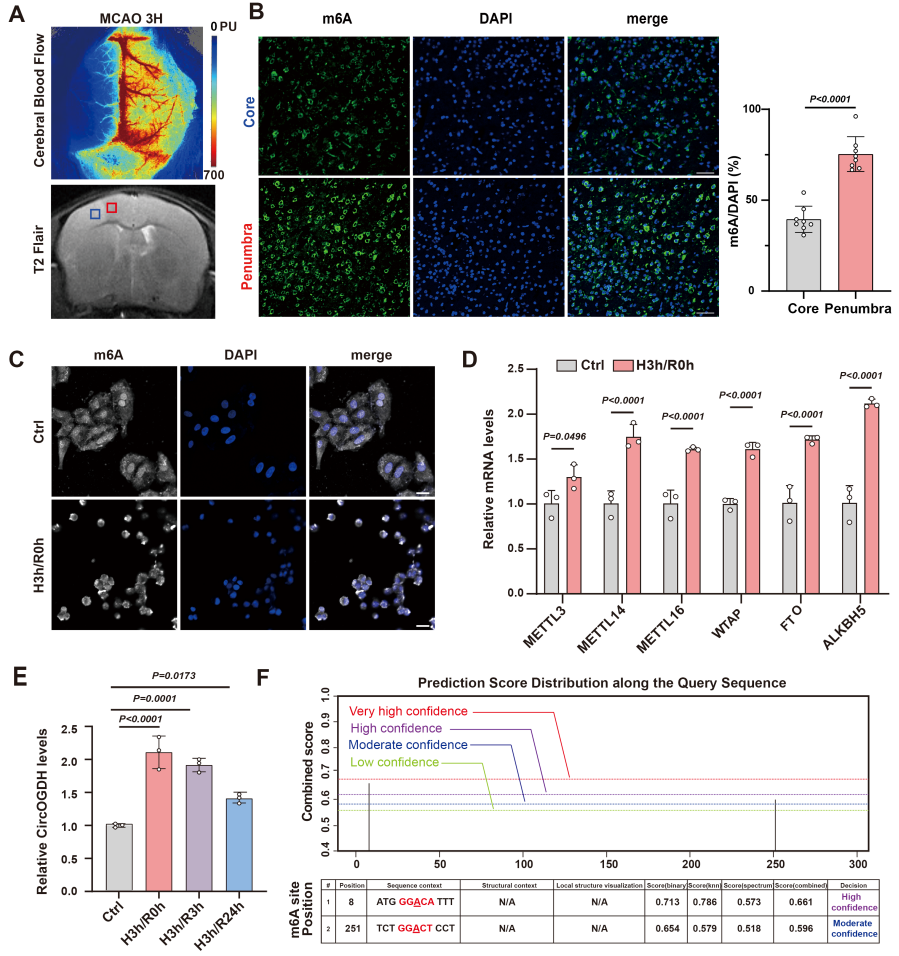
图1. 急性缺血神经元中m6A修饰的增加
为了确定参与CircOGDH m6A修饰的参与者,作者进行了RNA下拉试验并进行了蛋白质组学分析,并结合数据库联合分析,发现了可以与CircOGDH结合并且高表达的m6A读取器IGF2BP1。通过荧光原位杂交实验(FISH)联合免疫荧光染色发现CircOGDH与IGF2BP1在缺氧神经元细胞质中共定位。进一步通过Pearson相关分析显示,缺氧和再灌注不同时间间隔下CircOGDH和IGF2BP1的相对表达量呈正相关(R=0.676, P=0.016),均在缺氧急性期3小时表达水平最高。并且在小鼠急性卒中模型中,IGF2BP1表达主要定位在缺血半暗带神经元中。这些数据表明CircOGDH在缺氧神经元和半暗带神经元中与m6A读取器IGF2BP1结合。
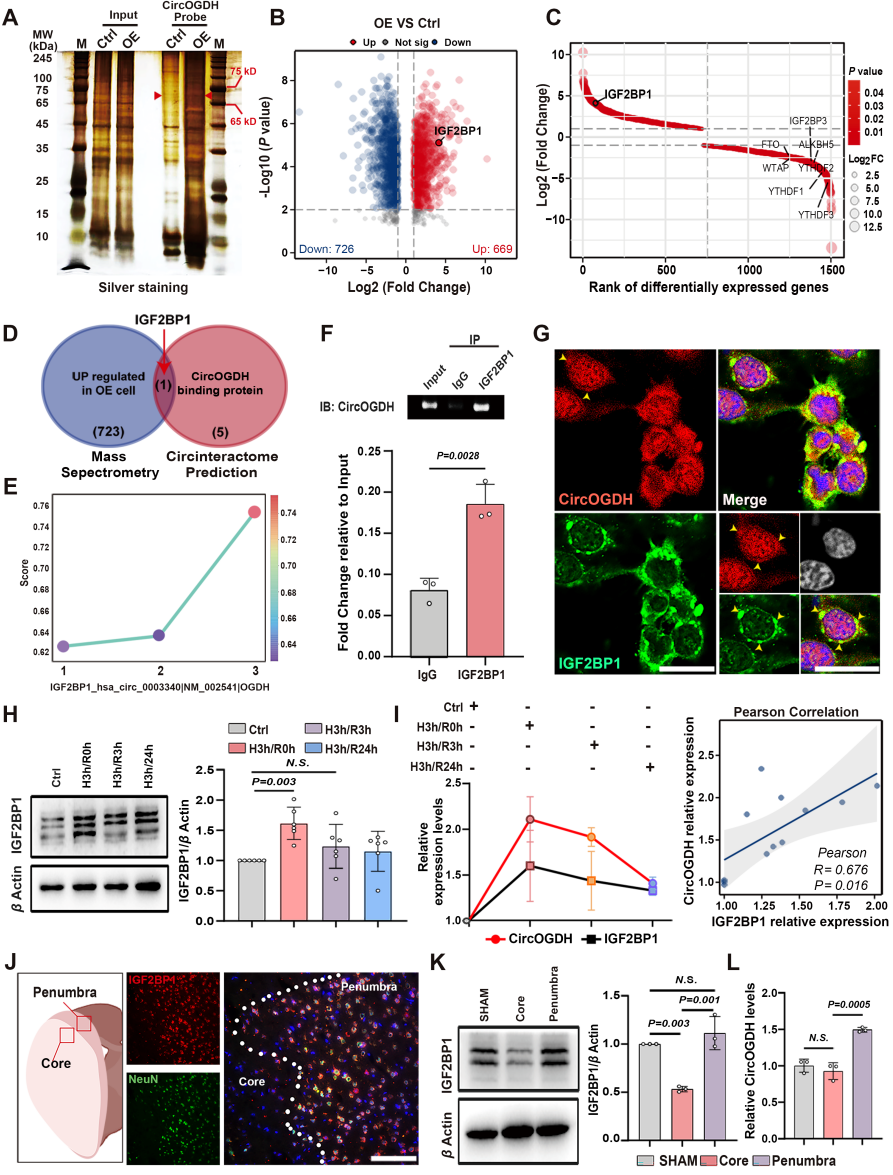
图2. 急性缺血神经元细胞中IGF2BP1表达与CircOGDH表达一致。
为了确定IGF2BP1特异性识别并结合缺血半暗带标志物CircOGDH的分子策略,研究团队首先敲低m6A甲基转移酶METTL3(参与催化靶mRNA m6A修饰),发现METTL3敲低显著降低了m6A对CircOGDH的修饰,结合RIP实验进一步确定敲低METTL3显著减少IGF2BP1与CircOGDH的结合。然后作者通过RNAfold、3dRNA以及ZDOCK等工具预测和构建包含有不同功能区域的IGF2BP1截断肽段,他们验证得出KH3-4结构域是IGF2BP1特异性识别CircOGDH接头序列的关键结构域。接着作者通过突变CircOGDH的2个m6A修饰位点,进行荧光素酶报告基因实验确定,与IGF2BP1结合的m6A修饰位点是位于接头位点的8号修饰位点。这些结果显示m6A修饰的CircOGDH可以直接结合IGF2BP1的KH3-KH4结构域。
m6A在circRNAs的代谢和功能中起着不可或缺的作用。相反,circRNA的异常表达会影响m6A修饰。他们首先过表达和敲低CircOGDH发现,CircOGDH的表达改变并不影响缺氧神经细胞中IGF2BP1的表达,以及其在细胞质的空间定位。而敲低IGF2BP1后,CircOGDH的表达明显降低,并且利用RNA稳定性实验进一步确认,敲低IGF2BP1后,缺氧时神经细胞中CircOGDH的半衰期明显缩短。这些数据表明m6A修饰有助于IGF2BP1在缺氧条件下稳定CircOGDH。
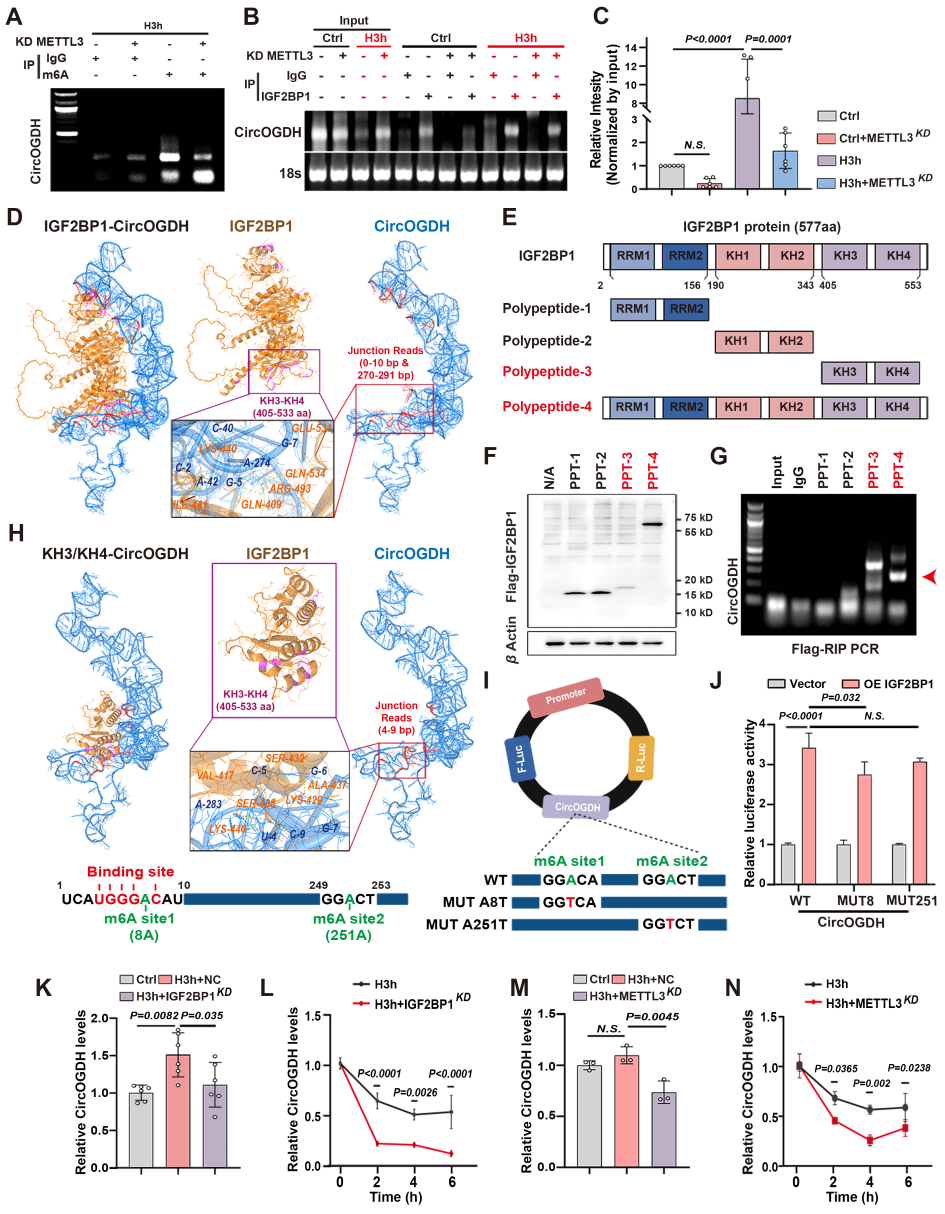
图3. 在低氧条件下IGF2BP1以m6A依赖的方式结合并调节CircOGDH的表达。
在AIS早期,应激颗粒(SGs)可瞬时抑制mRNA翻译,保护mRNAs和蛋白免受损伤。IGF2BP1与成熟SGs中致密颗粒的外围和内部形成相关。他们在缺氧神经细胞和人脑组织样本中发现IGF2BP1、CircOGDH与SGs的核心组分G3BP1存在明显空间共定位,CO-IP实验证明可以IGF2BP1与G3BP1结合。抑制SG的形成可以明显减少CircOGDH的丰度,并且在缺氧神经细胞中敲低IGF2BP1的表达,明显减少了SG组分中CircOGDH的丰度,减少了IGF2BP1、CircOGDH与G3BP1空间共定位。这些发现表明,在缺氧条件下神经元细胞中上调的IGF2BP1在细胞质中积累,并通过识别其m6A修饰位点与CircOGDH结合。这种结合稳定了CircOGDH,延长了其半衰期,并通过进入SGs减少了其降解。
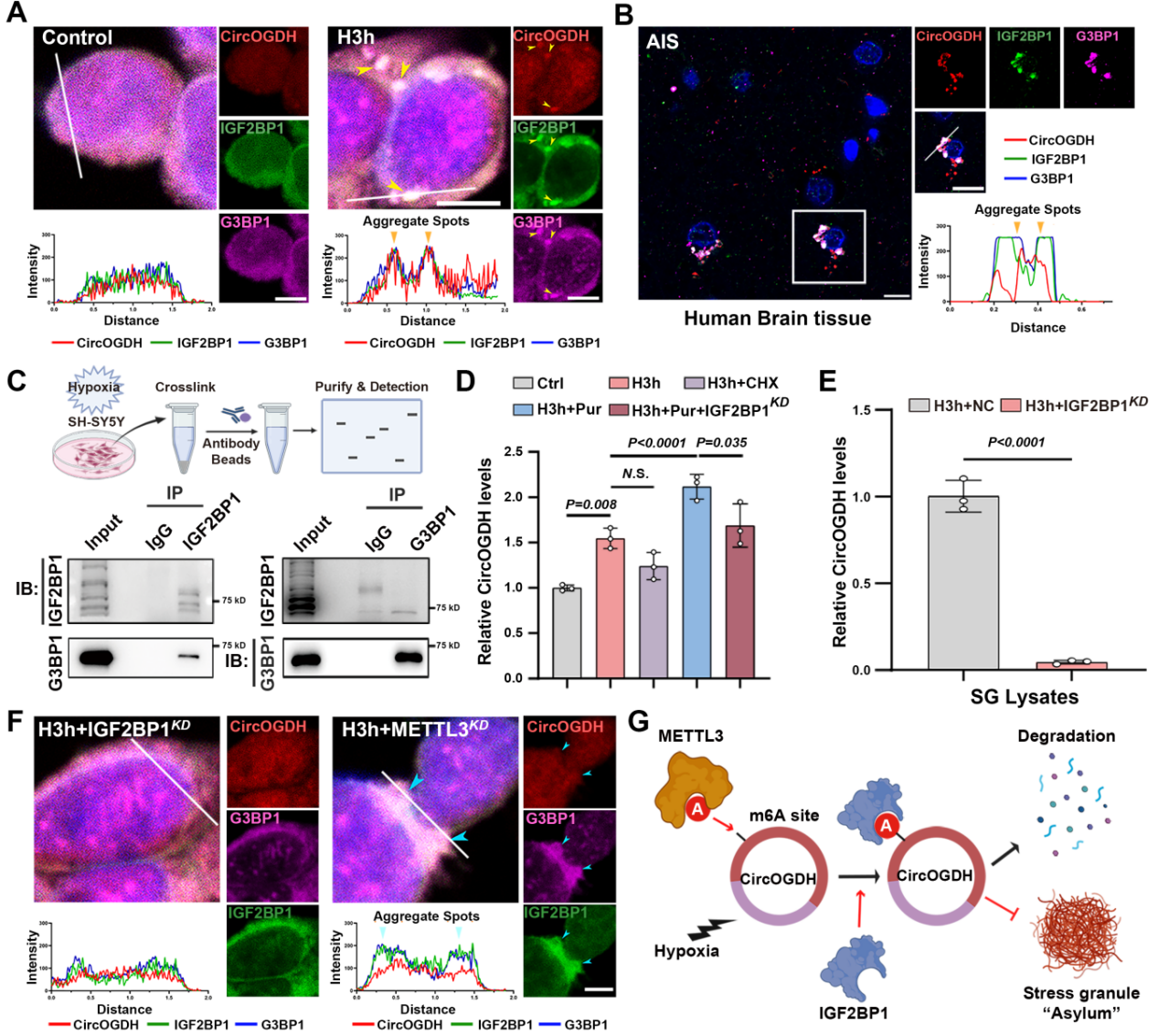
图4. IGF2BP1通过招募CircOGDH至应激颗粒(SGs)中,维持缺氧神经细胞中高水平的CircOGDH
该团队之前的研究结果表明,靶向敲低CircOGDH可减少缺血半暗带区的神经元凋亡(Circulation Research)。接下来他们在缺血半暗带区域敲低Igf2bp1的病毒,发现其可减少缺血半暗带区CircOGDH的表达,改善神经元凋亡,减少梗死体积。为了进一步探讨Igf2bp1敲低对神经元的保护作用是通过m6A修饰的CircOGDH的减少来介导的,我们重点研究了CircOGDH(非特异性m6A修饰的CircOGDH)和Igf2bp1(特异性m6A修饰的CircOGDH)的敲低,以验证它们在缺血条件下对半暗区神经元的作用。与单纯抑制CircOGDH相比,Igf2bp1敲除能更有效保护神经元,改善梗死体积。这些结果表明,IGF2BP1修饰的m6A-CircOGDH在神经细胞凋亡中起主要作用,其功能比简单的CircOGDH敲低更大。
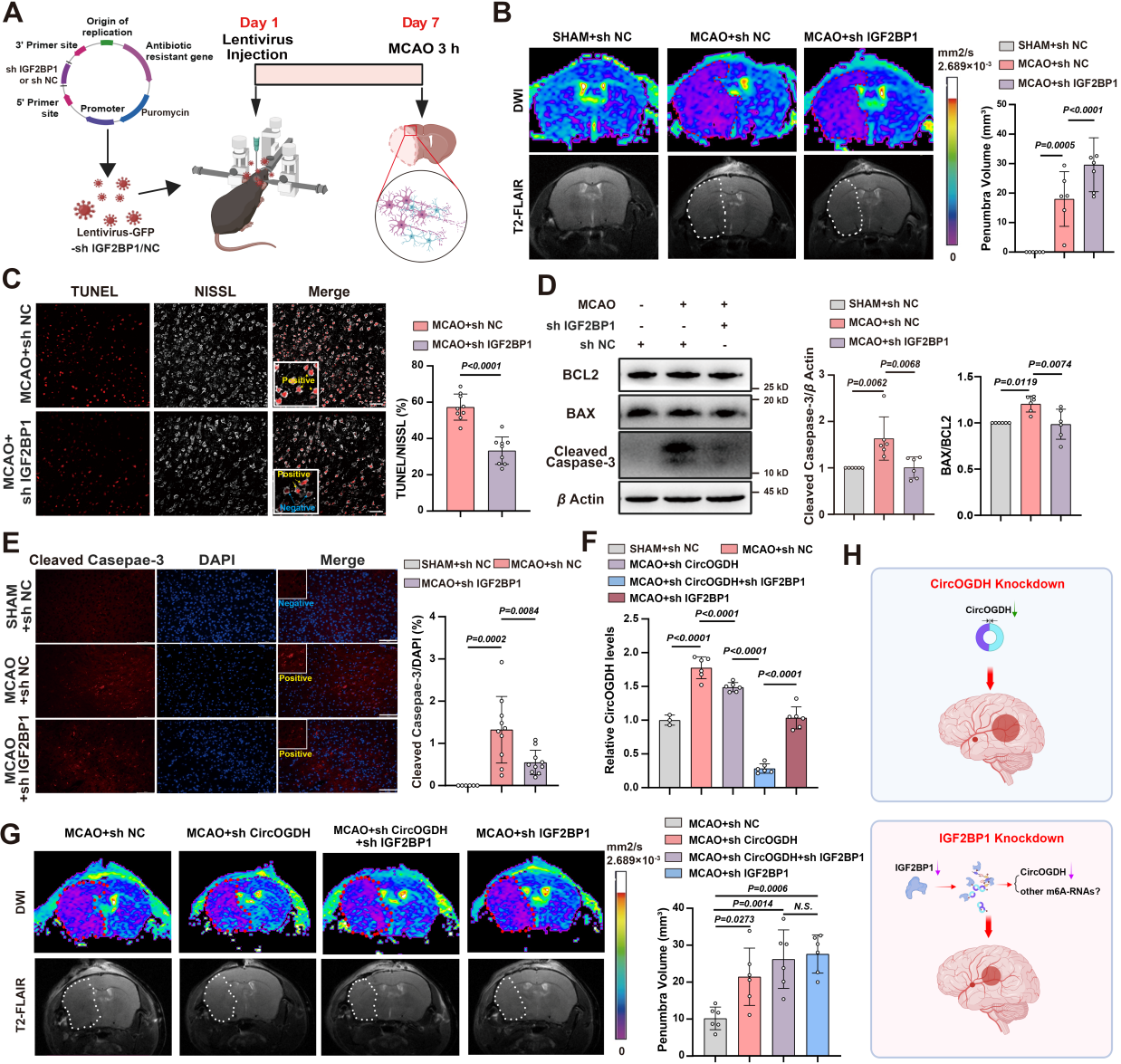
图5. Igf2bp1敲除减轻缺血半暗带神经元的凋亡
IGF2BP1在缺血性卒中(IS)患者的临床样本中升高,但其潜在的功能意义尚不清楚。IGF2BP1是AIS的关键治疗靶点,它促进半暗区神经元损伤和CircOGDH表达,可能是神经元中多种破坏性下游信号通路的中心枢纽。在脑损伤急性期维持突触功能可促进神经元恢复。因此,他们进一步检测了MCAO小鼠的突触水平,通过电镜和高尔基染色实验发现,敲低Igf2bp1后,突触蛋白PSD95、SYN的表达增加,突触完整性更好,树突棘的长度和密度更大。进一步通过meRIP-seq测序(本项测序技术服务由表观生物提供)分析显示,高甲基化基因在轴突发育和轴突发生富集,并主要定位树突和轴突。因此,他们推测IGF2BP1也可能调节一类在缺氧时影响轴突发育的高甲基化mRNA。
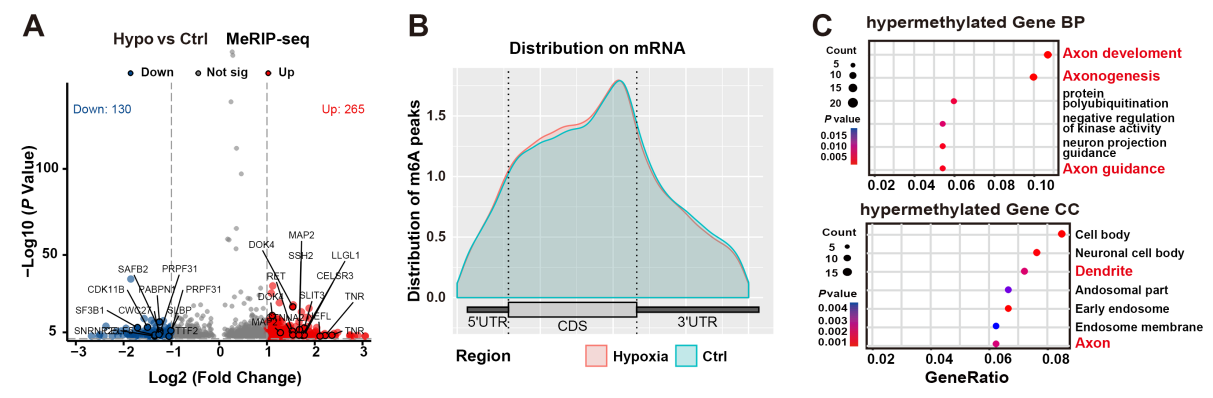
图6. 鉴别缺氧神经细胞与常氧神经细胞中差异表达且存在m6A修饰的RNA
总之,这项研究首次将m6A修饰、CircRNA动态改变与应激颗粒功能关联,解析半暗带神经元存活的分子机制,为开发新型脑细胞保护策略提供了理论依据,为缺血性卒中提供了新的调控治疗靶点,未来或可通过靶向IGF2BP1,延缓半暗带向梗死灶转化,改善卒中预后。
暨南大学附属第一医院为该研究的第一完成单位。逯丹研究员、徐安定教授、麦鸿成副研究员(合作单位:中山大学孙逸仙纪念医院)为本论文通讯作者。苏璇琳博士后、臧健坤博士后、王雅平博士、张世卿副教授为本论文第一作者。

