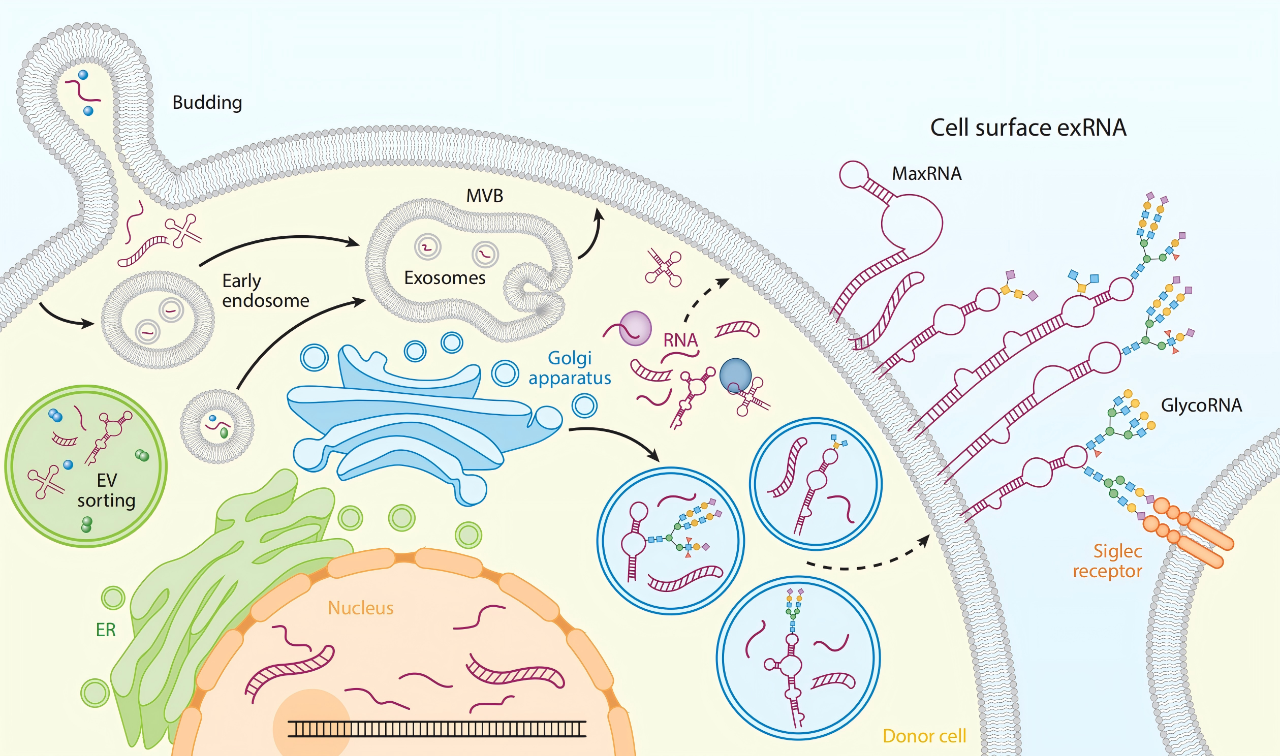
Nat Cell Biol | 胶质瘤风险SNP如何通过增强子网络促癌
胶质瘤是一种恶性程度高、预后极差的脑部肿瘤。尽管全基因组关联研究(GWAS)已成功鉴定出多个与胶质瘤发病风险显著相关的SNP,但绝大多数风险SNP位于基因组非编码区域,其潜在的生物学功能长期以来不甚明了。这些非编码变异如何通过调控增强子的远程相互作用来影响靶基因表达,并最终驱动肿瘤发生与发展,是当前肿瘤基因组学研究领域的一个关键且尚未解决的科学问题。

【DOI】10.1038/s41556-025-01737-3
【IF】19.1
【发表时间】2025年8月19日
【标题】Systematic decoding of functional enhancer connectomes and risk variants in human glioma
【单位/通讯作者】中山大学附属第一医院吕万革、张弩团队
【关键词】胶质瘤、增强子连接组、风险SNP、HiChIP、SOX18、MEIS1
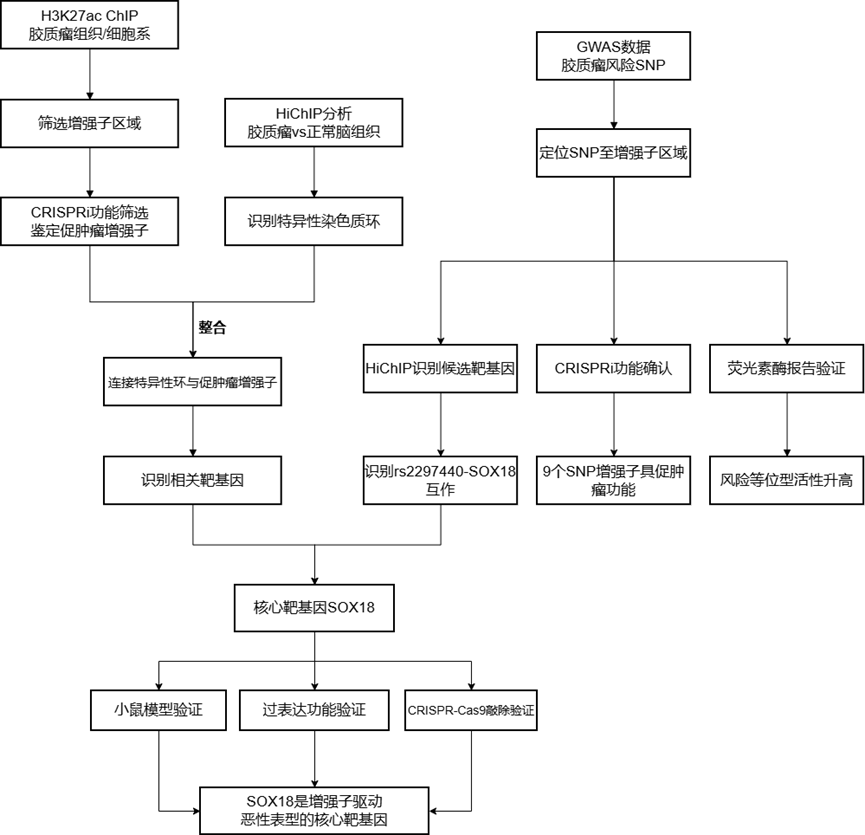
该研究通过整合高通量CRISPRi筛选与H3K27ac HiChIP染色质构象捕获技术,系统性地绘制了人胶质瘤中的功能性增强子连接组。研究揭示了非编码风险SNP通过改变增强子-启动子三维互作促进肿瘤进展的新机制。就是说携带风险SNP rs2297440的增强子通过特异性招募转录因子MEIS1,显著增强了其与原癌基因SOX18启动子之间的染色质环相互作用,从而驱动SOX18的高表达,促进胶质瘤细胞增殖与肿瘤生长。该研究不仅深化了对非编码区遗传变异在肿瘤中功能机制的理解,也为胶质瘤的靶向治疗提供了潜在的干预新靶点。
研究技术路线
关键研究结果
1.CRISPRi筛选系统性鉴定胶质瘤中的促肿瘤增强子
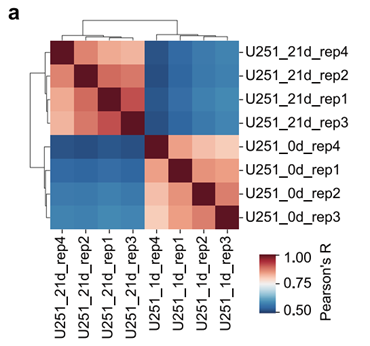
研究团队首先从38例胶质瘤组织及3种胶质瘤细胞系(U251、LN229、U87)的H3K27ac ChIP-seq数据中筛选出34,083个增强子区域,并设计包含90,049条sgRNA的文库进行CRISPRi功能筛选。筛选在U251细胞中进行四轮独立重复,结果显示各重复间高度一致。
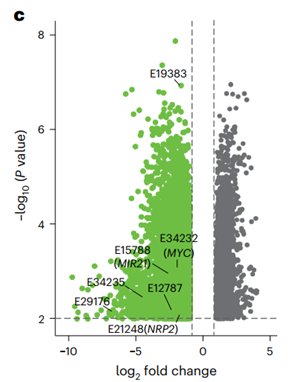
通过比较第0天与第21天sgRNA丰度变化,鉴定出那些sgRNA显著耗竭的增强子为“促肿瘤增强子”,其破坏可抑制肿瘤细胞生长。
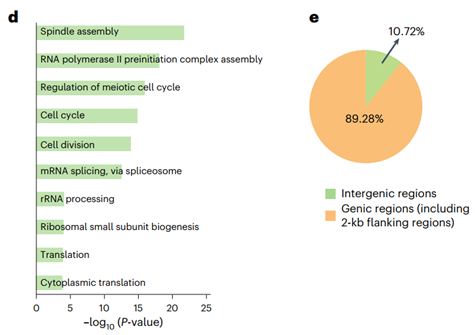
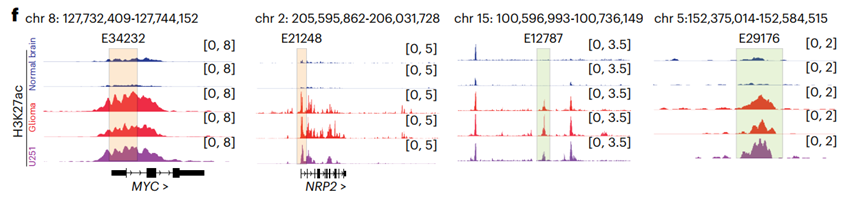
GO分析结果显示,这些增强子邻近的基因显著富集于细胞周期、mRNA剪接与翻译等通路,提示其在维持肿瘤细胞增殖中的核心作用。约89.28%的促肿瘤增强子位于基因间区,例如E12787和E29716,而其余位于启动子区。H3K27ac信号追踪进一步验证了这些增强子在胶质瘤中特异性激活。
2.整合HiChIP揭示胶质瘤特异性增强子连接组及其功能网络
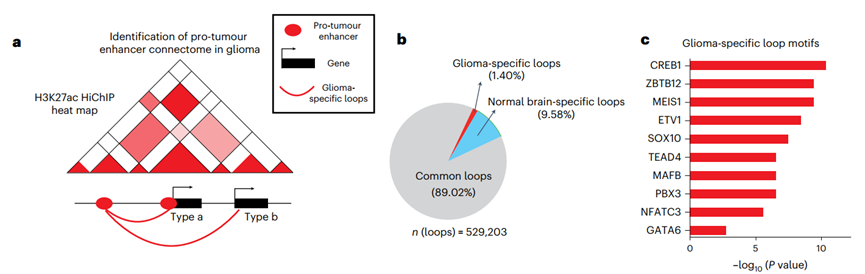
为进一步解析增强子如何远程调控基因,研究团队对原代胶质瘤组织及细胞系进行H3K27ac HiChIP分析,并与正常脑组织对比,鉴定出胶质瘤特异性染色质环。结果显示,虽然大多数环在肿瘤与正常组织中共享,但仍存在1.40%的胶质瘤特异性环,其锚点区域富集CREB1、MEIS1、ETV1等促增殖转录因子结合motif。
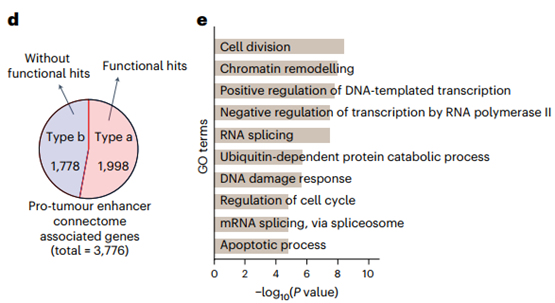
通过将这些特异性环与促肿瘤增强子连接,共识别出3,776个与增强子连接组相关的蛋白编码基因,其中1,998个在CRISPRi筛选中显示功能重要性。GO分析结果表明这些基因显著参与细胞分裂、DNA损伤应答等过程。
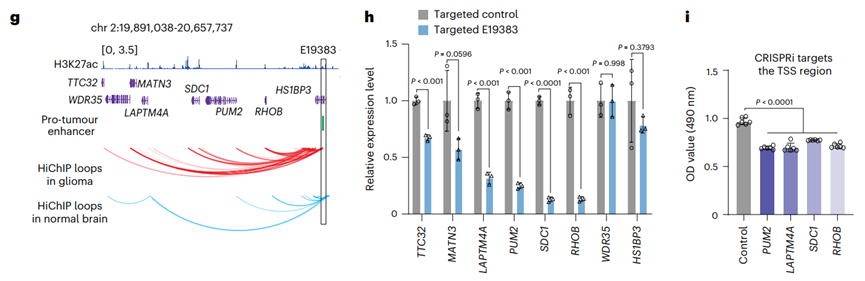
以E19383增强子为例,HiChIP显示其与多个基因存在物理互作;CRISPRi沉默E19383后,这些基因表达显著下降,且其启动子沉默可抑制细胞增殖。
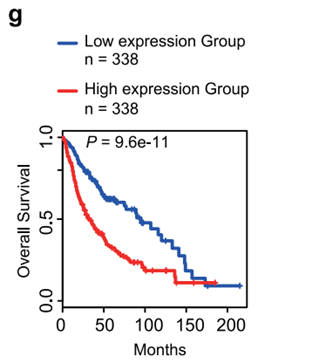
生存分析进一步证实,这些基因高表达与患者预后不良相关。
3.风险SNP通过增强子连接组驱动胶质瘤进展
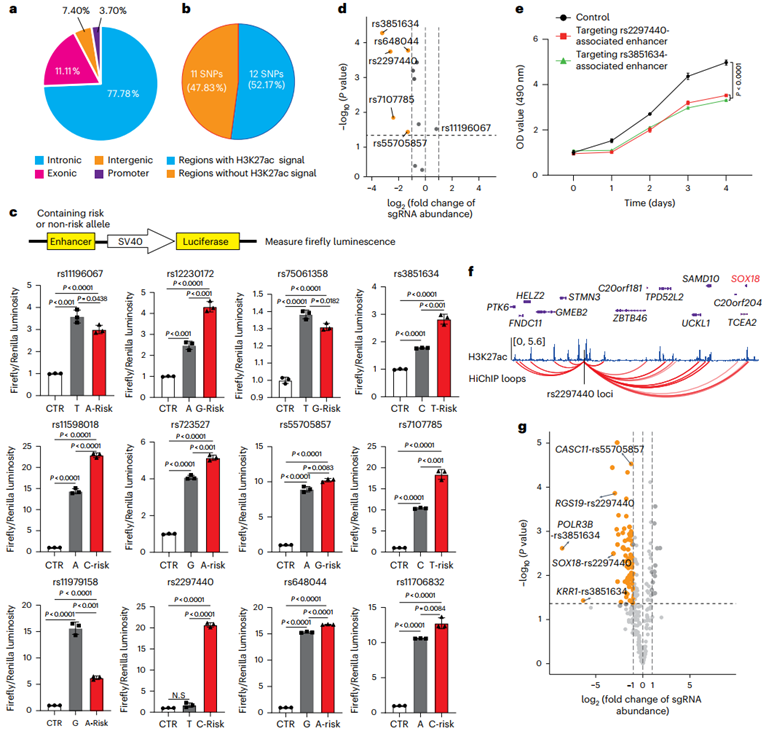
研究团队进一步分析GWAS中已报道的胶质瘤风险SNP,发现85.18%位于内含子或基因间区,其中12个SNP直接位于H3K27ac标记的增强子区域。荧光素酶报告实验显示,75%的风险等位型增强子活性显著高于非风险型。CRISPRi筛选确认其中9个增强子具有促肿瘤功能(包括rs2297440和rs3851634)。通过HiChIP分析,共识别出123个与这些SNP增强子互作的候选靶基因。例如,rs2297440增强子与SOX18、RGS19等基因存在特异性互作。功能验证显示,CRISPRi沉默 rs2297440增强子可显著抑制细胞增殖,且30.10%的候选靶基因在CRISPRi筛选中显示促生长作用。
4.rs2297440增强子通过调控SOX18表达促进胶质瘤生长
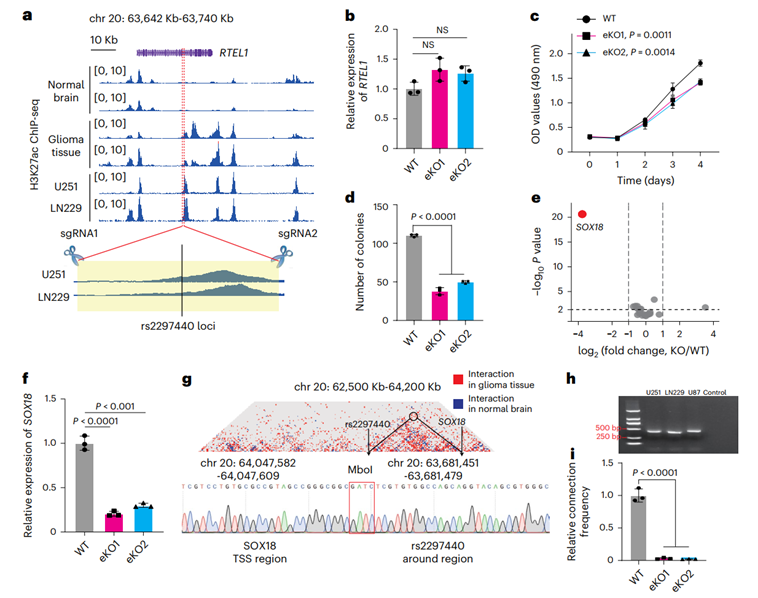
研究团队聚焦于rs2297440风险SNP,该位点位于RTEL1基因内含子区,但其增强子活性在胶质瘤中特异性升高。通过CRISPR-Cas9敲除该1.3 kb增强子区域(eKO),发现并不影响RTEL1表达,但显著抑制U251和LN229细胞增殖与克隆形成。RNA-seq分析显示,eKO细胞中多个与细胞迁移和分化相关通路基因表达改变,其中SOX18下调最为显著。HiChIP与3C-PCR进一步证实,rs2297440增强子与SOX18启动子在胶质瘤中存在特异性物理互作,且该互作在eKO细胞中被破坏。
5.MEIS1优先结合风险等位型以增强SOX18转录与肿瘤性
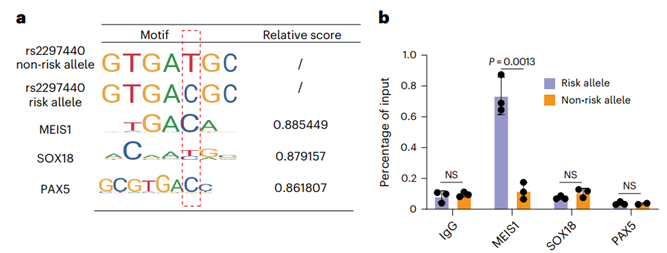
为解析rs2297440调控SOX18的具体机制,研究团队通过motif分析与ChIP-qPCR发现,转录因子MEIS1在风险等位型上结合强度显著高于非风险型。
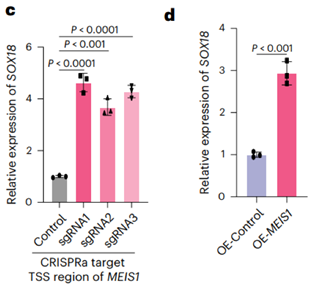
CRISPRa激活MEIS1表达可导致SOX18 mRNA水平显著上升,而体外过载MEIS1质粒也验证其对SOX18的转录激活作用,验证了MEIS1对SOX18的转录激活作用。研究证明,这种等位基因特异性的TF招募是驱动染色质环增强和靶基因过表达的核心环节。
6.SOX18过表达恢复增强子KO细胞的恶性表型
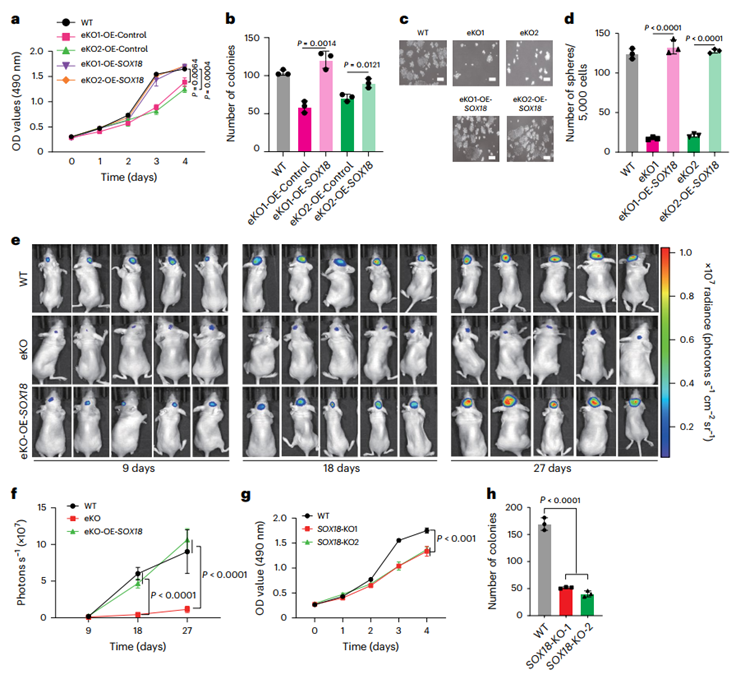
为验证SOX18是否作为rs2297440增强子的关键下游效应因子,研究团队在eKO细胞中过表达SOX18,发现其可显著恢复细胞增殖、克隆形成与干细胞球形成能力。在小鼠异种移植模型中,eKO抑制肿瘤形成,而SOX18过表达则完全恢复肿瘤发生能力。相反,CRISPR-Cas9敲除SOX18本身也显著抑制细胞生长与克隆形成。这些数据一致表明,SOX18是rs2297440增强子驱动胶质瘤恶性表型的核心靶基因。
总结
这项研究通过构建胶质瘤特定的三维基因组拓图,论证了“增强子连接组”在定义肿瘤细胞特有的染色质拓扑结构中的核心地位。研究证实了非编码基因组的变异并非孤立存在,而是通过改变远程染色质环的物理连接,将遗传风险转化为功能性的基因表达变化;特别是揭示了多效性转录因子在风险位点上的差异性招募,是驱动这种功能性拓扑结构重塑的关键因素。这种系统性解码非编码遗传变异的研究范式,不仅为解析肿瘤易感位点的生物学效应提供了普适性方法,也为从三维空间基因调控的角度开发精准医疗方案及寻找预后标志物提供了全新的切入点。