一文梳理糖基化RNA研究领域的演进,顶刊成果全回顾
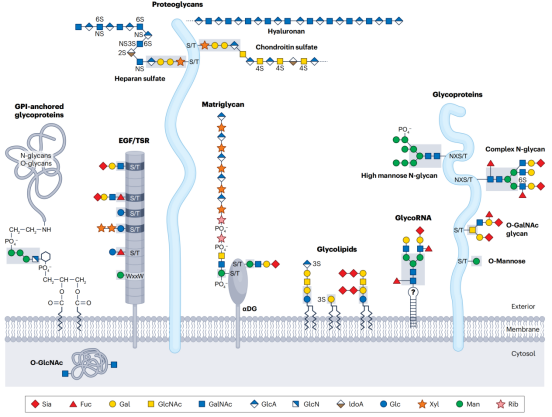
多样化糖组[1]
糖基化(Glycosylation)作为细胞内最常见、最复杂的翻译后修饰之一,通过酶促方式将糖链附着到生物分子如蛋白质和脂质上。它在调控蛋白质折叠、稳定性、细胞信号传导和免疫响应中发挥关键作用。
与此同时,RNA作为遗传信息的传递者,虽然拥有m6A、m5C等超过170种化学修饰来调控自身的稳定性或翻译效率,但长期以来,科学界普遍认为RNA与糖基化是绝缘的。原因很简单:空间隔离。RNA主要存在于细胞核和细胞质中,而糖基化过程发生于内质网和高尔基体,最终展示在细胞表面。两者看似毫无交集。然而,2021年,cell一篇突破性研究打破了这一成见。
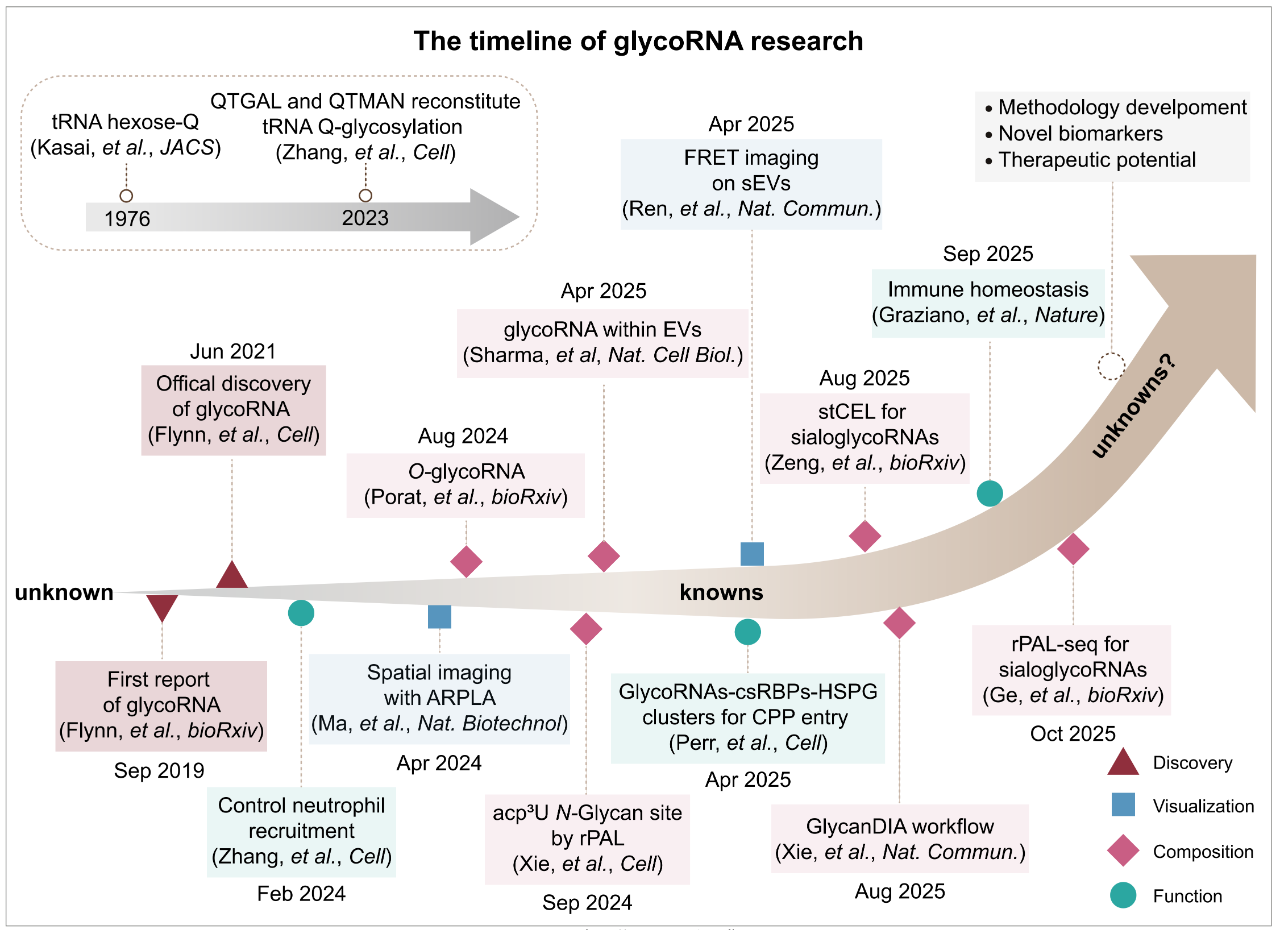
糖基化RNA(glycoRNA)的研究时间线[2]
其实,关于RNA可能被糖基化修饰的线索早在1976年就已浮现。当时有学者在tRNA的Q碱基上发现了己糖残基[4],随后又有研究发现RNA末端可能带有UDP-葡萄糖等修饰[5]。但受限于当时的检测技术,这些零星的发现并未引起广泛关注,RNA是否真的能像蛋白质一样挂上复杂的糖链,一直是个未解之谜。
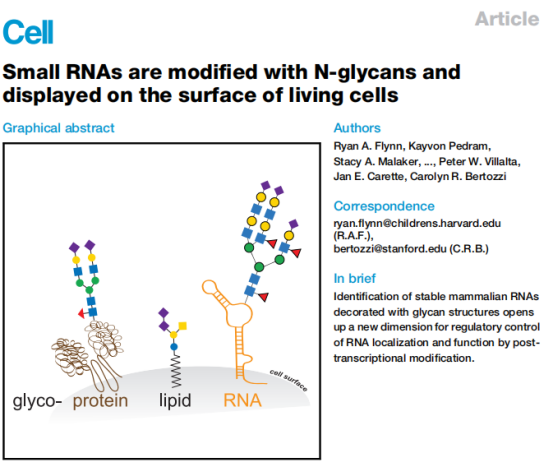
直到2021年,斯坦福大学的Flynn等人利用代谢标记(Metabolic Labeling)和生物正交化学(Bioorthogonal Chemistry)技术,彻底捅破了这层窗户纸。研究人员使用叠氮标记的唾液酸前体(Ac4ManNAz)处理细胞,发现在经过严格蛋白酶处理后的纯化RNA上,依然检测到了叠氮信号。这一信号在HeLa细胞、胚胎干细胞乃至小鼠肝脏组织中均普遍存在。
glycoRNA的分子特征[2]
分子特征:
-
身份:它们并非mRNA,而是属于非编码小RNA。主要包括Y RNA、snRNA、snoRNA以及tRNA等。
-
结构:这些RNA分子上挂载着复杂的N-聚糖,富含唾液酸(Sialic acid)和岩藻糖(Fucose)。
-
合成路径:研究表明,其生物合成依赖于经典的内质网-高尔基体中的糖基转移酶以及OST复合体(寡糖转移酶)。
-
定位:细胞表面。
已知功能:
-
作为免疫调节配体,参与细胞间通讯和免疫信号的调节。
-
形成表面功能结构,作为细胞穿透肽进入细胞的位点。
-
参与疾病过程,glycoRNA在炎症反应中促进中性粒细胞的招募。
-
维持免疫稳态,N-糖链掩盖具有免疫刺激性的acp3U碱基,防止先天免疫受体错误识别,促进凋亡细胞的非炎症性清除。
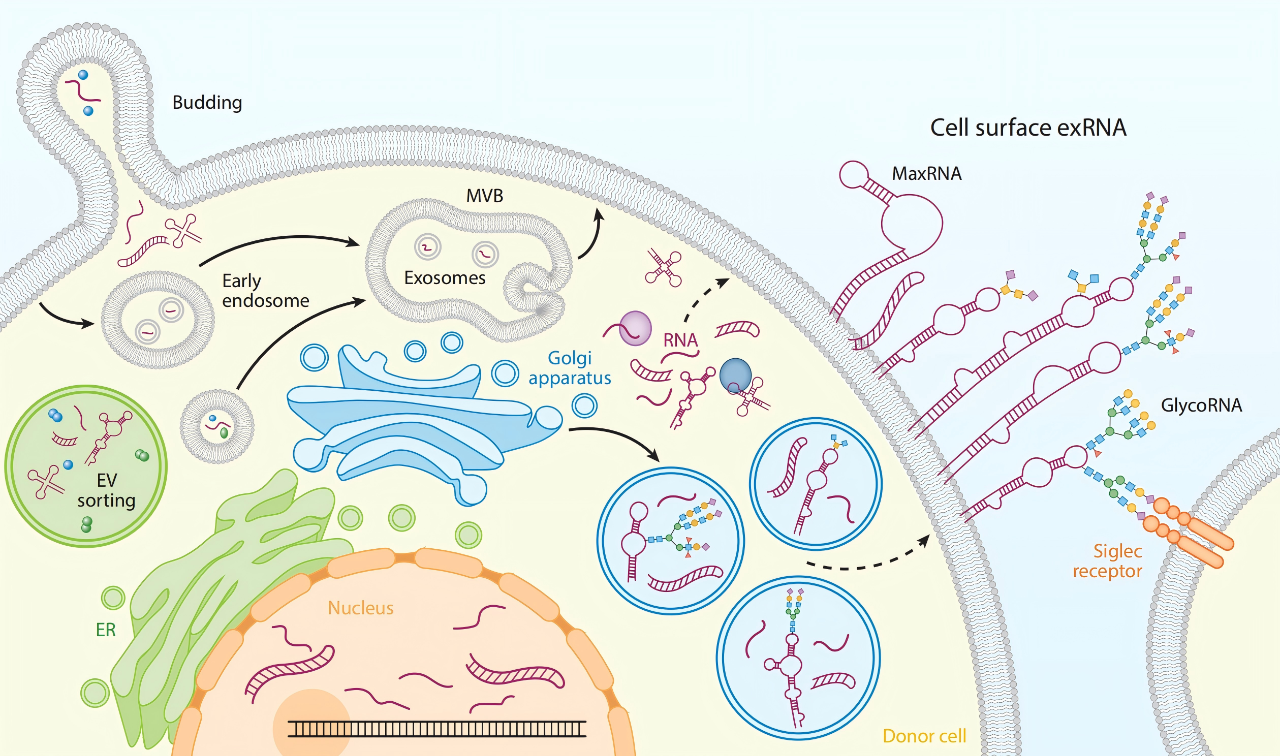
glycoRNA的内质网-高尔基体分泌途径[6]
glycoRNA的生物合成依赖于经典的蛋白质N-糖基化途径。这一过程主要发生在内质网和高尔基体中:首先由寡糖转移酶(OST)复合体(特别是STT3A亚基)将聚糖前体转移至RNA上,随后聚糖链在细胞内经由甘露糖苷酶等酶类的剪切与修饰,逐步成熟为带有唾液酸和岩藻糖的复杂N-聚糖结构;研究证实,无论是利用小分子抑制剂(如NGI-1)阻断OST活性,还是干扰UDP-Gal/UDP-GalNAc等糖代谢关键底物的合成,都会直接导致glycoRNA生成的显著减少,确立了其与蛋白质糖基化机器的紧密联系。

广州RNA club | Ryan A. Flynn 《细胞表面糖基化RNA生物学》
关注表观生物视频号,观看直播回放
Ryan A. Flynn教授讲座最全笔记 《细胞表面糖基化RNA生物学》
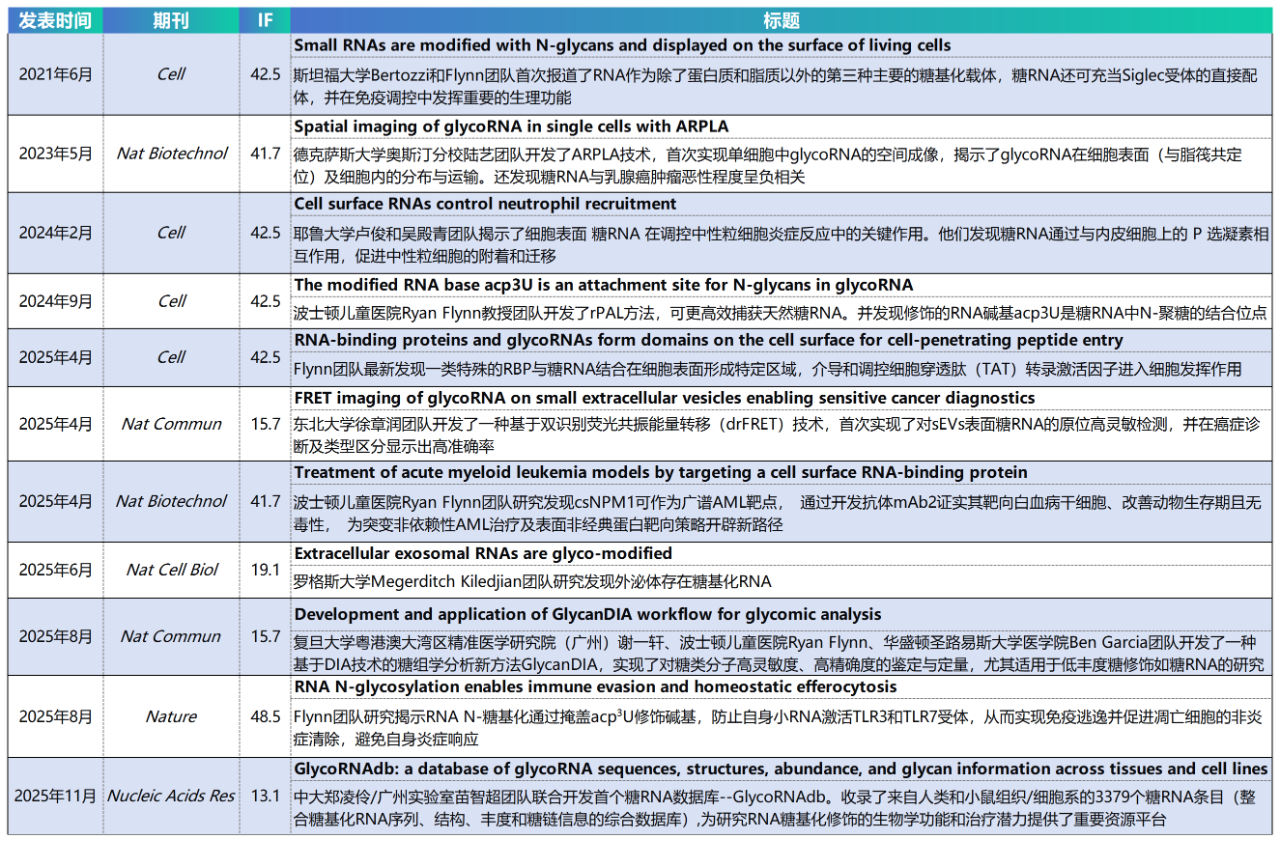
近几年来,glycoRNA作为新兴研究领域,陆续取得一些突破性进展,其中不乏顶刊文章,下面我们来盘点下都产出了哪些顶刊成果:
该研究开发了一种名为ARPLA(Aptamer and RNA in situ hybridization-mediated Proximity Ligation Assay)的新型成像技术。该方法的核心原理是双识别与信号放大:首先,使用一个包含唾液酸(Neu5Ac)适配体的聚糖探针特异性结合glycoRNA末端的唾液酸化聚糖;同时,使用一个RNA结合探针通过RISH特异性结合目标glycoRNA的RNA序列。只有当这两个探针在空间上足够接近(即同时结合到同一个glycoRNA分子上)时,它们携带的DNA连接子(linker G和linker R)才能被连接酶连接成一个完整的环状DNA。此环状DNA随后作为模板,进行滚环扩增(RCA),产生长的单链DNA串联体,最后通过与大量荧光标记的报告DNA杂交,产生强烈的荧光信号,从而在单细胞水平上实现对特定glycoRNA的原位、可视化检测。
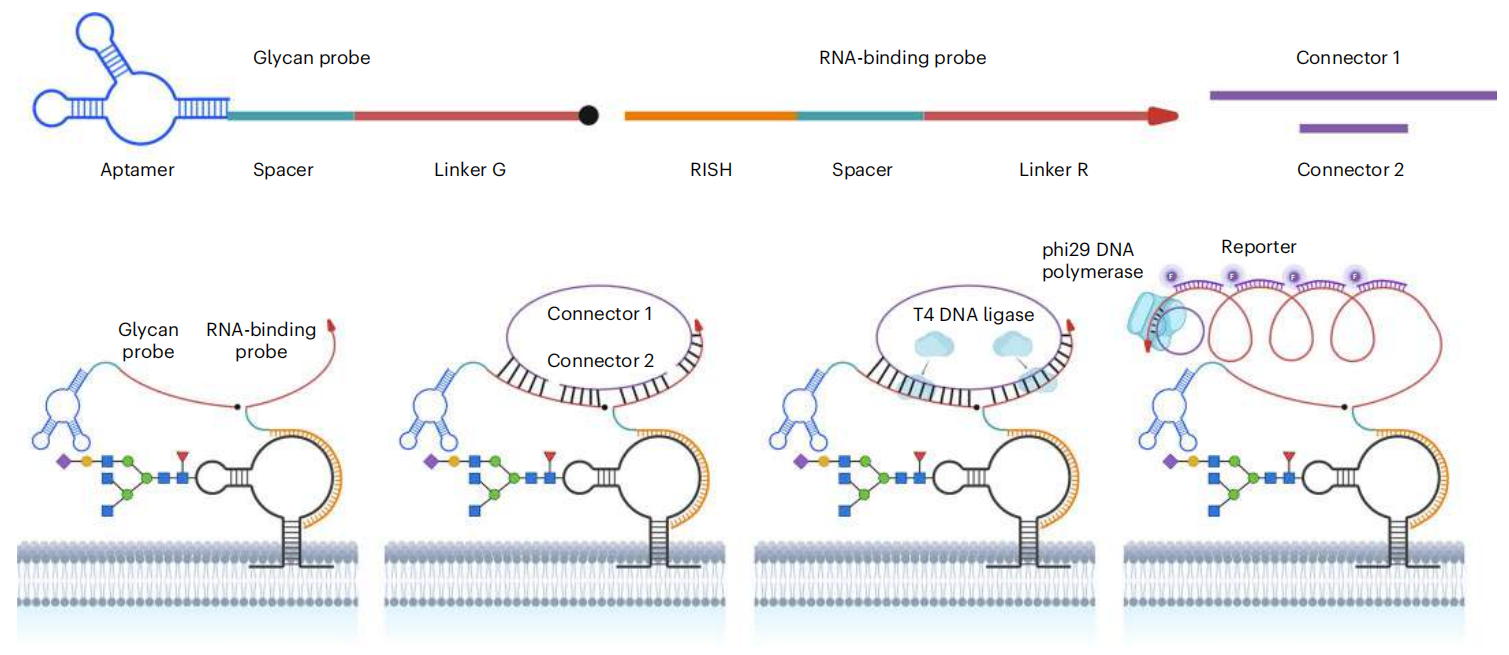
ARPLA的技术原理
技术亮点:
-
高特异性与低背景:依赖聚糖和RNA序列的双重识别,只有两者同时存在且空间邻近时才产生信号,有效避免了单独检测细胞表面游离糖链或非glycoRNA带来的假阳性。
-
免标记、可定制的原位成像:无需对细胞进行代谢标记等预处理,可直接对天然状态的glycoRNA成像;通过更换RNA结合探针的序列,可以灵活靶向成像不同的特定glycoRNA(如U1、U3、Y5等)。
-
单细胞级精度:借助RCA的高灵敏度,该技术可以在单细胞水平上清晰地看到glycoRNA的分布点。
应用效果与生物学发现:
利用ARPLA,研究人员首次清晰地观察到glycoRNA富集在细胞膜表面的脂筏(Lipid rafts)区域,并揭示了其通过SNARE蛋白介导的胞吐途径运输到细胞表面的过程。
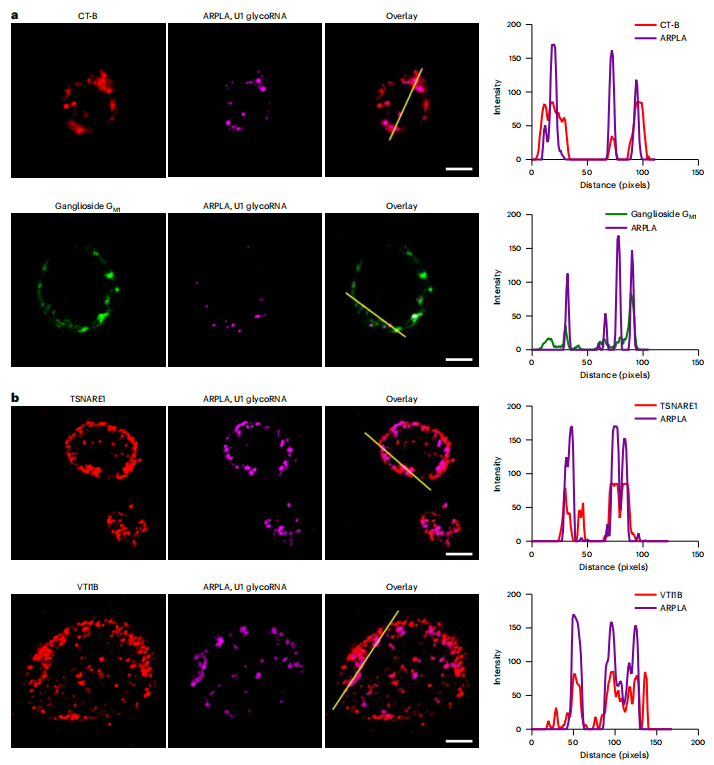
癌症与免疫新视角:
1. 在乳腺癌模型中发现,细胞表面的glycoRNA水平与肿瘤的恶性程度及转移能力呈负相关。
2. 在免疫细胞中,glycoRNA参与调节单核细胞与血管内皮细胞的粘附互作,提示其在免疫应答中的关键角色。
表观生物公众号也转载过这篇作者的会议报告,感兴趣可跳转阅读(讲座分享│ARPLA技术首次实现单细胞水平糖基化RNA(GlycoRNA)成像)。
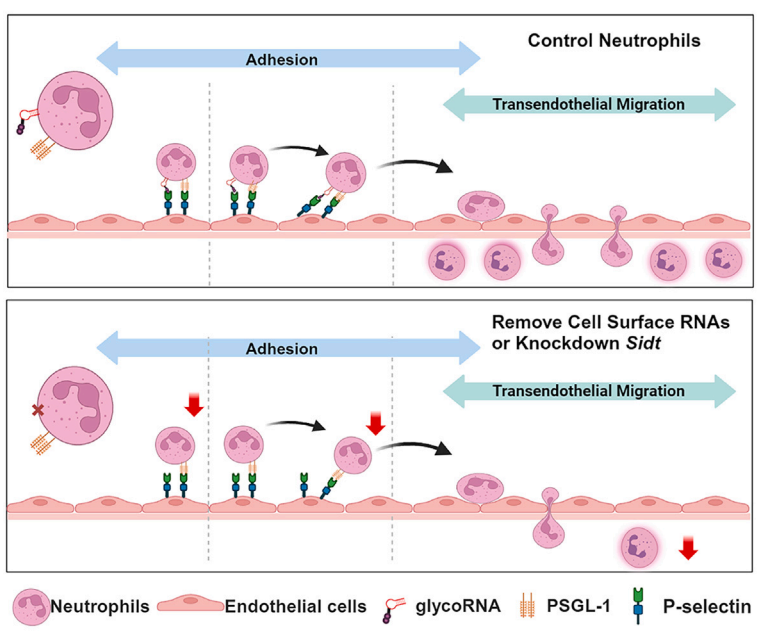
研究内容:
该研究旨在探究细胞表面RNA,特别是glycoRNA,在中性粒细胞向炎症部位招募过程中的生物学功能及其作用机制。研究聚焦于glycoRNA是否以及如何影响中性粒细胞的粘附、滚动和跨内皮迁移等关键步骤。
研究方法:
-
glycoRNA检测与定位:使用Ac4ManNAz代谢标记结合点击化学(DBCO-PEG4-biotin)和蛋白质印迹,检测并证实glycoRNA存在于中性粒细胞外表面。
-
功能缺失实验:使用exRNaseA处理去除活细胞表面的RNA,或利用CRISPR技术敲低Sidt1和Sidt2基因,以研究细胞表面RNA的功能。
-
体内外功能验证:
-
体内招募模型:采用硫代乙醇酸盐(TG)诱导的急性腹膜炎模型和LPS诱导的急性肺炎模型,通过混合标记(如CFSE和Far-Red)并回输经不同处理的中性粒细胞,利用流式细胞术定量分析其在炎症部位的招募效率。
-
体外相互作用实验:进行静态粘附实验、流动腔粘附/滚动实验以及transwell跨内皮迁移实验,评估glycoRNA对中性粒细胞与内皮细胞相互作用的影响。
-
机制探究:
-
受体鉴定:使用重组P-selectin-Fc和E-selectin-Fc蛋白,通过流式细胞术和WB分析glycoRNA与选择素的直接结合。
-
来源模型验证:设计共培养实验,将Ac4ManNAz标记和未标记的中性粒细胞混合培养,然后分选,以证明glycoRNA是细胞自主产生而非从环境中捕获的
-
测序分析:对纯化的glycoRNA进行小RNA测序,分析其RNA组成。
关键结果:
-
功能确认:去除细胞表面RNA(exRNaseA处理)或敲低Sidt基因,会显著损害中性粒细胞在体内向炎症部位的招募,并削弱其体外与内皮细胞的粘附和跨内皮迁移能力。
-
关键基因:Sidt1和Sidt2基因是中性粒细胞产生glycoRNA所必需的,敲低它们会消除glycoRNA信号,且细胞丧失了迁移能力。
-
作用机制:中性粒细胞表面的glycoRNA能够被内皮细胞上的P-选择素(Selp)识别并结合,但不结合E-选择素(Sele)。用纯化的glycoRNA或其糖链部分(而非RNA部分)阻断内皮细胞,能模拟exRNaseA处理的效果,降低中性粒细胞粘附。
-
自主合成:共培养实验证明,glycoRNA是细胞自主合成并转运到其表面的,而非从周围环境中摄取。
-
RNA特征:中性粒细胞glycoRNA主要是来源于核基因组非编码小RNA片段。
研究结论:
中性粒细胞通过其表面展示的glycoRNA,作为配体与血管内皮细胞上的P-选择素结合,从而介导中性粒细胞在炎症初期对血管壁的捕获和滚动,这是其成功招募到炎症部位的关键步骤。该过程依赖于Sidt家族蛋白介导的RNA转运。
自2021年glycoRNA被发现以来,存在这样的疑问:RNA如何与N-聚糖连接在一起?N-聚糖是直接连接在RNA上还是存在一个特定的连接结构?
针对这个问题,Ryan Flynn团队进行深入研究与解析:
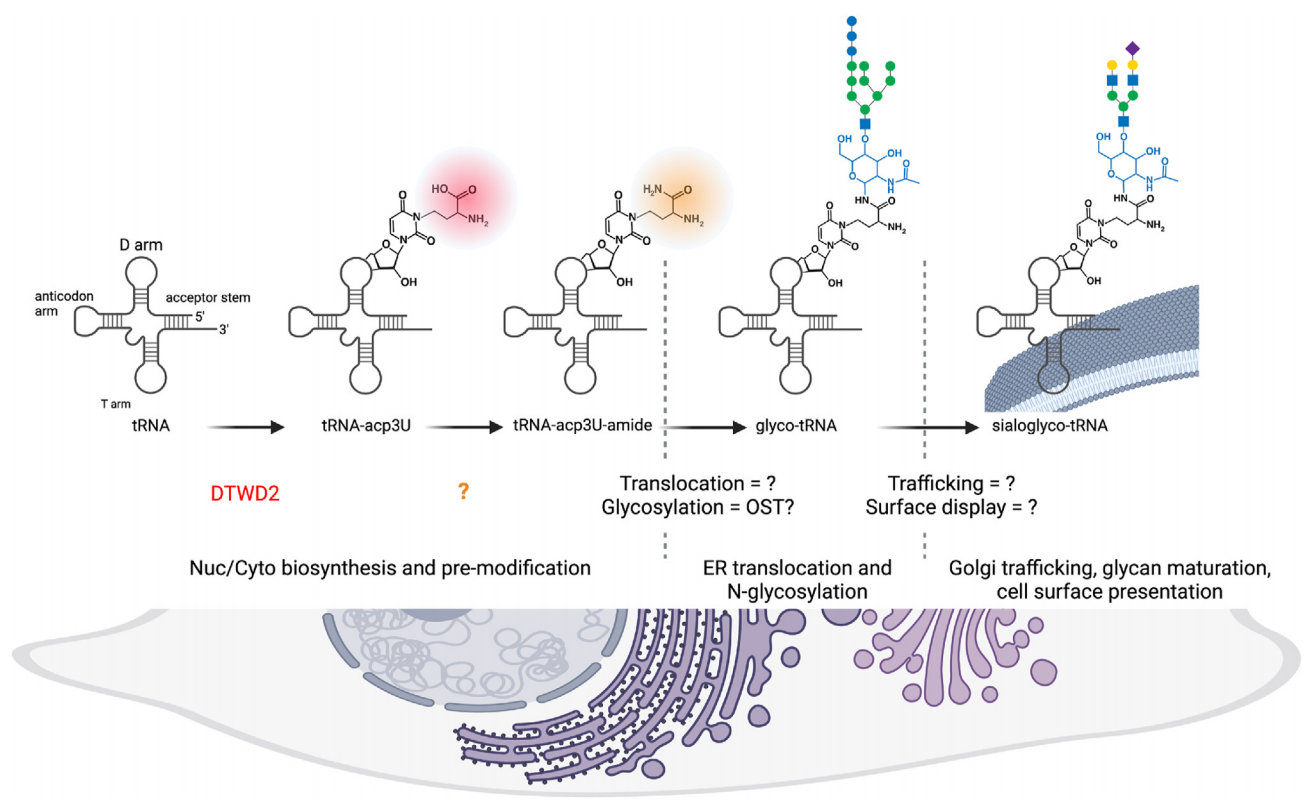
谢一轩等人[7]解开glycoRNA分子结构的关键谜题。他们发现,一种名为acp3U(3-氨基-3-羧基丙基尿嘧啶)的RNA碱基修饰是N-聚糖在glycoRNA上的主要连接点。
关键实验方法:
-
rPAL技术(RNA优化的过碘酸氧化与醛基连接):他们开发了一种名为rPAL的化学标记方法。相比于传统的代谢标记(Ac4ManNAz),rPAL不依赖细胞代谢,能直接标记天然的唾液酸修饰RNA,灵敏度提高了25倍以上,甚至能检测到以前看不到的微量信号。
-
SWATH-MS(全景式质谱分析):结合rPAL富集和高精度的质谱分析,研究人员在复杂的RNA混合物中大海捞针,寻找带有糖链残基的核苷酸片段。
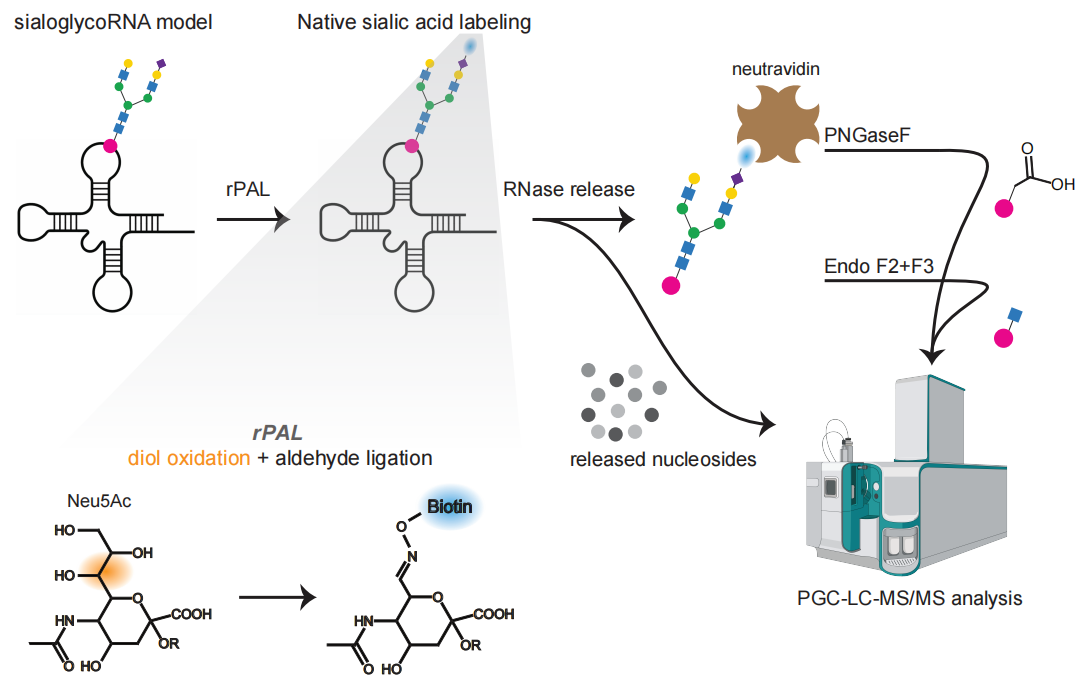
关键研究结果:
-
锁定连接位点“acp3U”:研究发现,N-聚糖并非连接在普通的A、U、C、G上,而是连接在一种名为acp3U的修饰碱基上。
-
化学拟态机制:acp3U碱基上带有一个氨基侧链,这个结构在化学性质上酷似蛋白质中的天冬酰胺。因此,细胞内的OST复合体把这个RNA碱基误认为了蛋白质,从而把糖链挂了上去。
-
关键酶DTWD2:既然连接位点是acp3U,那么合成acp3U的酶就至关重要。研究证明,敲除负责生成acp3U的酶DTWD2,细胞就无法生成glycoRNA。
他们提出了一个关于唾液酸glycoRNA的假设模型。对于tRNA,在DTWD2的作用下核苷酸首先发生acp3U的修饰。随后,这一修饰经历酰胺化过程后被转移到内质网中,形成初始的糖基结构,经加工得到成熟的N-聚糖结构。最终,tRNA被运送到细胞表面。这一模型为理解糖RNA的生成提供了新的见解,揭示了其可能的生物合成路径。
那么,糖RNA存在于细胞表面的具体机制是什么?Ryan Flynn团队今年4月发表的一篇CELL文章展示了一些线索:
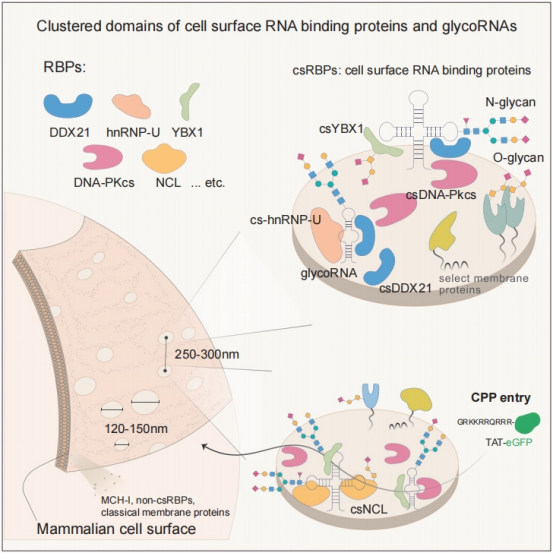
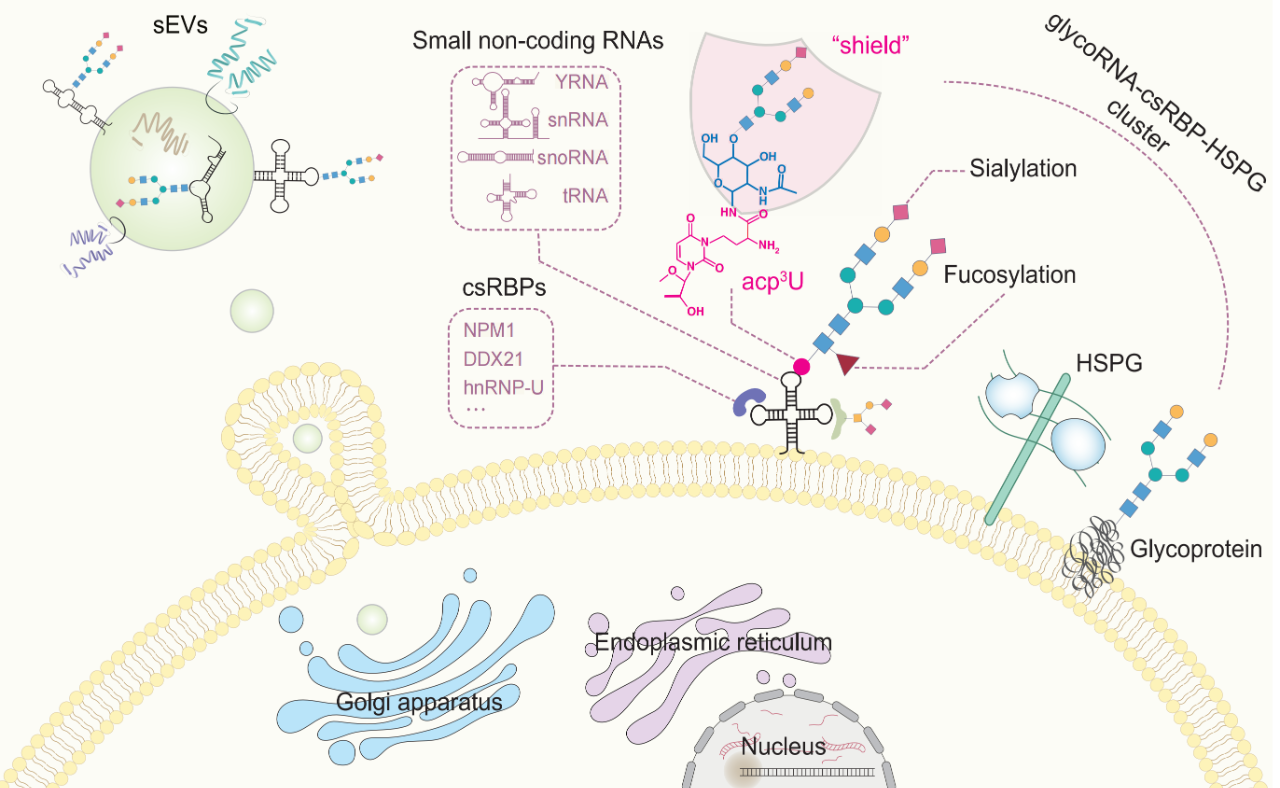
理论上,RBP通常缺乏跨膜结构域或信号肽,无法被分选到细胞膜上。因此,Flynn团队最初推测,细胞表面几乎不会存在RBP。然而,他们对RBP和表面蛋白组数据集进行了交集分析,意外发现了292个RBP存在于细胞表面。前面提过glycoRNA可作为配体与P-选择素结合发挥作用。还能与细胞表面RNA结合蛋白(csRBP)组装成纳米簇。它们是孤立存在的吗?这项研究旨在探究这些分子在细胞表面的空间组织形式。作者想知道它们是否随机分布,还是形成了特定的结构?如果有结构,这些结构又有什么功能?
关键实验方法:
-
蛋白质组学分析:整合了来自48个RBP数据库和21个表面蛋白质组(surfaceome)的数据集,通过生物信息学交叉分析,系统性地鉴定高置信度的csRBP。
-
多正交验证:使用多种生化与成像方法,验证候选csRBP在多种细胞系表面的真实存在。
-
超分辨率成像与纳米簇分析:采用衍射极限共聚焦显微镜和超分辨率显微镜技术,直观显示csRBP在细胞表面形成离散的纳米级簇。通过定量分析(如最近邻距离、Manders系数)确定这些簇的尺寸和间距。
-
邻近标记与共定位研究:利用基于过氧化物酶的邻近标记技术,结合质谱分析,证明csRBP与细胞表面RNA(使用抗dsRNA抗体9D5标记)在纳米尺度上紧密共定位,并且这些RNA具有糖基化特征(对唾液酸酶敏感)。
-
功能实验:
-
RNase处理:使用exRNase处理去除表面RNA,观察其对csRBP纳米簇形成及TAT肽结合与内化的影响。
-
TAT突变体:构建并测试了TAT肽的RNA结合关键残基突变体(R5K),评估其细胞表面结合和内化效率的变化。
关键研究结果:
-
超分辨成像显示,glycoRNA并非均匀分布,而是与特定的csRBP(如NPM1、DDX21、hnRNP-U)紧密抱团,形成直径约120-165 nm的纳米簇结构。这些簇在细胞表面就像一个个孤岛,间隔有序(约230-300 nm)。
-
不仅是RNA和蛋白,还有HSPG:这些纳米簇的形成还需要细胞表面的硫酸乙酰肝素蛋白聚糖(HSPG)参与,三者共同构建了一个稳定的超分子复合物。
-
这些纳米簇不仅仅是结构,还是功能门户。研究发现,这些glycoRNA-csRBP纳米簇充当了细胞穿透肽(如HIV-1 TAT蛋白)的停机坪。TAT蛋白必须结合到这些含RNA的纳米簇上,才能被细胞内吞。如果破坏了表面的RNA,TAT就进不去了。
研究结论:
细胞表面存在一种高度有序的超分子结构——GlycoRNA-csRBP-HSPG纳米簇。这种结构不仅重新定义了我们对细胞膜组织的认知,更揭示了外源分子(如病毒蛋白、药物载体)进入细胞的一种全新RNA依赖性机制,为药物递送提供了潜在的新靶点。
基于上一个研究,Ryan Flynn团队趁热打铁,针对csRBP作为治疗靶点的疗效进行了探索:
该研究旨在探索并验证csRBP作为癌症治疗新靶点的潜力。研究聚焦于核磷蛋白NPM1,发现其全长形式(csNPM1)选择性地在多种癌细胞表面表达,尤其是在急性髓系白血病(AML)的原始细胞和白血病干细胞上,而在正常的造血干细胞上不表达。研究开发了一种靶向csNPM1的单克隆抗体(mAb2),并系统评估了其在多种AML临床前模型中的治疗效力和安全性。
抗体开发与体内药效评估:
-
表面蛋白组学筛选:对比癌细胞和正常细胞的表面蛋白,锁定了NPM1(通常在核仁,但在白血病细胞表面高表达)。
-
单克隆抗体开发:基于人源scFv文库,开发了靶向NPM1 C端结构域的小鼠IgG2a单克隆抗体mAb2。
-
临床前模型验证:在多种小鼠白血病模型(包括患者来源的异种移植PDX模型)中测试抗体疗效。
-
机制与安全性探究:使用免疫缺陷小鼠模型(NSG,CB17-SCID)探究mAb2的抗白血病作用是否依赖于免疫效应功能(如ADCC/CDC)。
关键研究结果:
-
csNPM1是AML的普适性表面标志物:csNPM1在大量原代AML患者样本(包括不同基因型)的原始细胞上高表达,且与突变类型无关,而在正常造血干细胞上表达极低。
-
mAb2展现出强效抗白血病活性:在多种AML小鼠模型中,mAb2治疗能显著降低白血病负荷、缩小脾脏、促进正常造血恢复,并大幅延长生存期,其疗效在携带MLL重排的患者来源异种移植模型中也得到证实。
-
作用机制依赖免疫系统:mAb2在缺乏功能性免疫系统的NSG小鼠中无效,而在具有完整补体系统的CB17-SCID小鼠中有效,表明其疗效主要通过抗体依赖性细胞毒性和/或补体依赖性细胞毒性介导。
详细解读请跳转阅读(Nat Biotechnol | 靶向糖RNA结合蛋白NPM1:急性髓系白血病治疗的新策略与机制探索)
不同于前面的叠氮修饰甘露糖(Ac4ManNAz)代谢标记方法,该研究使用另一种叠氮修饰的N-乙酰半乳糖胺(Ac4GalNAz)标记细胞,成功追踪到糖基化RNA从细胞内到外泌体的完整转运路径。
研究采用了两种互补的生化分离策略:首先将细胞核与总胞质分离,然后进一步将胞质细分为可溶性胞质部分和膜结合细胞器部分。通过近红外(IR-800)信号检测,意外发现glycoRNA定位于胞质中。另外,他们也成功分离了外泌体中的糖基化RNA,并通过Nanopore测序技术进行了全面表征。数据显示,细胞来源和外泌体来源的糖基化RNA谱高度一致,包括tRNA、Y RNA、snRNA和snoRNA等小非编码RNA。
关键发现:
外泌体糖基化RNA(glyco-exoRNA)携带独特的非经典RNA帽结构,这些结构由多种核苷酸糖衍生物修饰而成;这些糖基化修饰在外泌体RNA中富集程度远高于胞内RNA,暗示其在稳定RNA和介导细胞间通讯中的特殊功能;glyco-exoRNA在不同癌细胞系中呈现特异性的表达谱,有望成为新型液体活检标志物。研究进一步发现,这些糖基化修饰对保护外泌体RNA免受核酸酶降解至关重要,同时介导了外泌体与靶细胞的特异性识别和结合。
详细解读请跳转阅读(Nat Cell Biol | 外泌体 RNA 的糖基化修饰)
该研究开发了一种名为双识别Förster共振能量转移(drFRET)的新型成像技术,用于在原位、高灵敏度、高特异性地检测小细胞外囊泡(sEV)表面的glycoRNA,并成功将其应用于多种癌症的精确诊断。
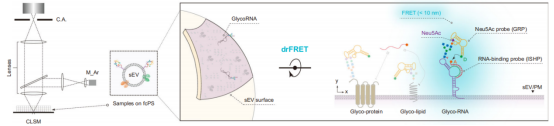
方法:
-
drFRET探针设计:设计两种DNA探针:糖链识别探针(GRP),其适配体可特异性结合Neu5Ac;RNA原位杂交探针(ISHP),可特异性结合目标RNA序列。两种探针分别标记供体(Cy3)和受体(Cy5)荧光染料。
-
检测原理:当GRP和ISHP同时结合到同一个sEV表面的glycoRNA分子上(即糖链和RNA部分在10 nm以内)时,发生FRET,产生校正后的FRET信号,从而实现glycoRNA的特异性检测。
-
sEV捕获与检测:使用偶联了HER2蛋白适配体的fcPS从微量血清或细胞培养上清中捕获sEV,然后进行drFRET成像和信号定量分析。
-
临床队列验证:使用drFRET检测5种特定sEV glycoRNA的水平,并评估其诊断效能。
关键结果
-
实现高精度癌症诊断:在100例临床样本中,将5种sEV glycoRNA的信号简单加和(sEV⁽SUᴹ⁾签名),能够以100%的准确率(AUC = 1)区分癌症患者与非癌症对照。
-
实现癌症分型:基于sEV⁽SUᴹ⁾签名的drFRET检测,结合PCoA分析,能够以89%的总体准确率对六种不同的癌症类型(乳腺癌、胰腺癌、肝癌、肠癌、肺癌、宫颈癌)进行分类。
-
drFRET成像证实,sEV表面的glycoRNA能够与免疫受体Siglec-10、Siglec-11以及P-selectin特异性结合。
-
去除sEV表面的RNA(使用RNase A处理)或糖链(使用唾液酸酶处理),会显著降低sEV被内皮细胞等摄取的能力,提示glycoRNA在介导sEV与细胞相互作用及内化过程中起关键作用。
详细解读请跳转阅读(Nat Commun | 细胞外囊泡glycoRNA:新型drFRET技术实现外囊泡糖RNA成像与高灵敏度癌症诊断)
对于像glycoRNA这样丰度低、结构复杂的分子,传统的DDA质谱方法往往力不从心。谢一轩/Ryan Flynn/Ben Garcia团队开发一种全新的质谱分析流程,以实现对低丰度糖链的高灵敏度鉴定和精准定量。
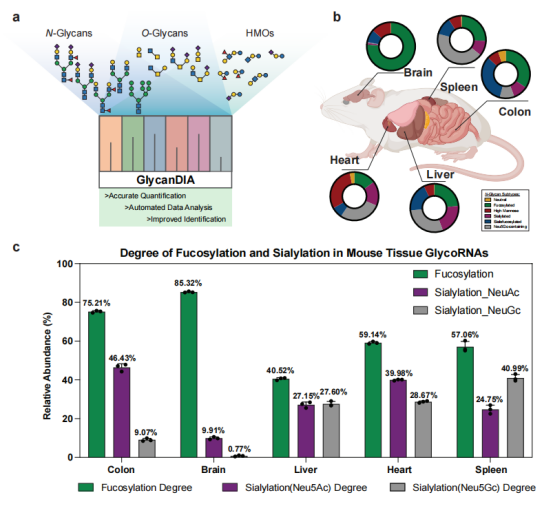
实验方法
-
GlycanDIA工作流:结合了高能碰撞解离(HCD)-MS/MS和交错质量窗口(staggered windows)的DIA采集方案,对预设质量范围内的所有前体离子进行无偏碎片化,避免了DDA方法因仅选择丰度最高的离子而导致的低丰度离子信息丢失。
-
GlycanDIA Finder搜索引擎:配套开发了自动化数据分析软件,采用迭代诱饵搜索策略,用于从复杂的DIA数据中自信地鉴定聚糖。
-
应用验证:将该工作流应用于分析N-聚糖、O-聚糖和人乳寡糖等多种聚糖类型,并重点用于分析从培养细胞和小鼠组织中提取的RNA样本上的N-聚糖。
关键结果
-
提升低丰度检测:在分析掺入低浓度同位素标记标准品的样本时,GlycanDIA在连续10次运行中均能稳定鉴定所有标准品,而DDA方法在60%的运行中会漏检。
-
异构体区分:能够基于色谱保留时间和特征碎片离子,有效区分具有相同质量但结构不同的聚糖组成异构体和连接异构体。
-
揭示RNA聚糖独特特征:将该技术应用于HeLa细胞和不同小鼠组织的glycoRNA分析,揭示了RNA上的N-聚糖与蛋白质上的N-聚糖在丰度模式上存在显著差异(例如RNA上更多高甘露糖型,且有组织特异性)。
详细解读请跳转阅读(Nat Commun | 谢一轩/Ryan Flynn/Ben Garcia团队开发糖组学分析新方法GlycanDIA)
RNA出现在细胞表面或内吞体中通常是危险信号(如病毒入侵),会触发强烈的免疫反应。但glycoRNA天天在这些地方晃悠却相安无事。这项研究旨在解开这个谜题:糖链修饰(如N-糖基化)究竟起到了什么保护作用?
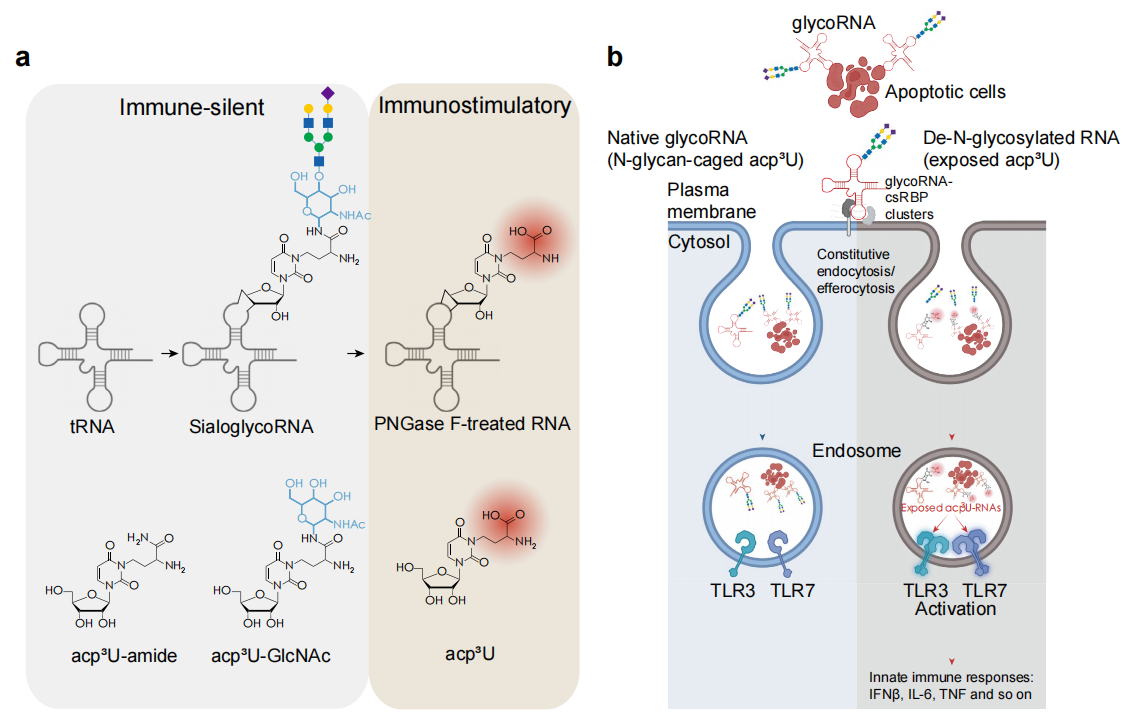
N-糖基化的glycoRNA通过掩盖免疫刺激性修饰碱基acp3U,防止内源性小RNA被先天免疫系统误识别为外来分子,从而在细胞稳态和凋亡细胞清除(胞葬)过程中避免有害的自身免疫反应。
核心发现与机制:
-
免疫逃避功能:位于细胞表面和循环系统中的glycoRNA,其N-糖链像笼子一样,物理性地屏蔽了其下方的修饰碱基acp3U。Acp3U本身具有免疫刺激性,当glycoRNA被去糖基化(如用PNGase F处理)后,暴露的acp3U会被巨噬细胞等免疫细胞的内体RNA传感器识别。
-
关键免疫受体:研究证实,去糖基化RNA的免疫激活依赖于TLR3和TLR7这两个内体Toll样受体。遗传敲除(TLR3 KO、TLR7 KO)或适配蛋白敲除(MyD88 KO、TRIF KO)会消除其诱导的I型干扰素(如IFN-β)和炎症因子(如TNF, IL-6)反应。
-
维持胞葬稳态:在细胞凋亡并被吞噬细胞(如巨噬细胞)清除的过程中,细胞表面的glycoRNA确保了这一过程的“免疫静默”。如果凋亡细胞的glycoRNA被去糖基化,会触发强烈的炎症反应;而天然的、糖基化的RNA则不会。
-
遗传学验证:敲除负责合成acp3U的酶DTWD2,会导致细胞无法产生acp3U,进而使其RNA(即使去糖基化)失去免疫刺激性。这反向证明了acp3U是触发免疫响应的关键元件。
-
与自身免疫病的潜在关联:研究在人和小鼠血清中均检测到循环glycoRNA,并发现其去糖基化后同样能激活免疫反应。这提示,glycoRNA代谢或功能的异常可能与系统性红斑狼疮(SLE)等因自身核酸异常识别引发的自身免疫疾病有关。
该工作将RNA生物学、糖科学和免疫学紧密联系起来。它解释了生物体如何利用糖基化修饰来标记“自我”RNA,从而在利用RNA进行细胞间通讯(如通过外泌体)和维持组织稳态(如清除死细胞)的同时,避免引发有害的自身炎症。这为理解自身免疫疾病的发病机制和开发新的治疗策略提供了全新的视角和潜在靶点。
详细解读请跳转阅读(Nature | 最新揭秘RNA糖基化在调控先天免疫识别与维持稳态中的功能)
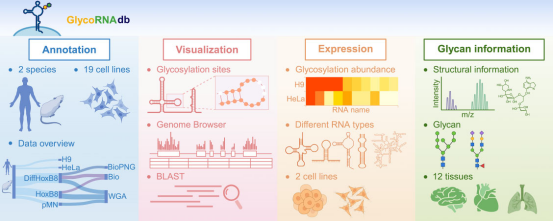
中山大学郑凌伶/广州实验室苗智超团队构建了全球首个glycoRNA综合性数据库GlycoRNAdb,为这一新兴领域奠定了数据基础设施。该数据库整合了来自多组学研究的glycoRNA序列、结构功能注释和糖基化位点信息,采用创新的命名系统——如glyco_SNORD3B-1-201格式,既保留了Ensembl转录本名称的可识别性,又通过唯一ID确保数据可追溯性。技术架构上,GlycoRNAdb采用React.js前端框架结合D3.js可视化技术,通过Docker容器化部署实现环境可重现,配备Nginx HTTPS加密和Gunicorn WSGI优化,确保高并发访问下的稳定性能。
GlycoRNAdb的核心价值在于其强大的功能集成:内置的BLAST模块可快速从未知RNA序列中识别潜在glycoRNA;RESTful API支持程序化数据提取;批量下载功能提供CSV/FASTA格式数据用于离线分析。研究团队通过案例展示了该数据库在TRITAT 2-1 RNA(hsa-glycoRNA-145a)研究中的应用,验证了其从序列识别到功能注释的全流程支持能力。
相信GlycoRNAdb的建立能够解决glycoRNA研究领域数据分散、缺乏专用资源的核心瓶颈。帮助科研人员便捷地查询和比较不同条件下glycoRNA的特征与表达模式。为研究glycoRNA在细胞间通讯、免疫调控和疾病中的功能与诊断潜力提供数据基础。未来助力glycoRNA研究从基础发现到临床应用转化。
详细解读请跳转阅读(NAR | 首个glycoRNA多组学数据库“GlycoRNAdb”)
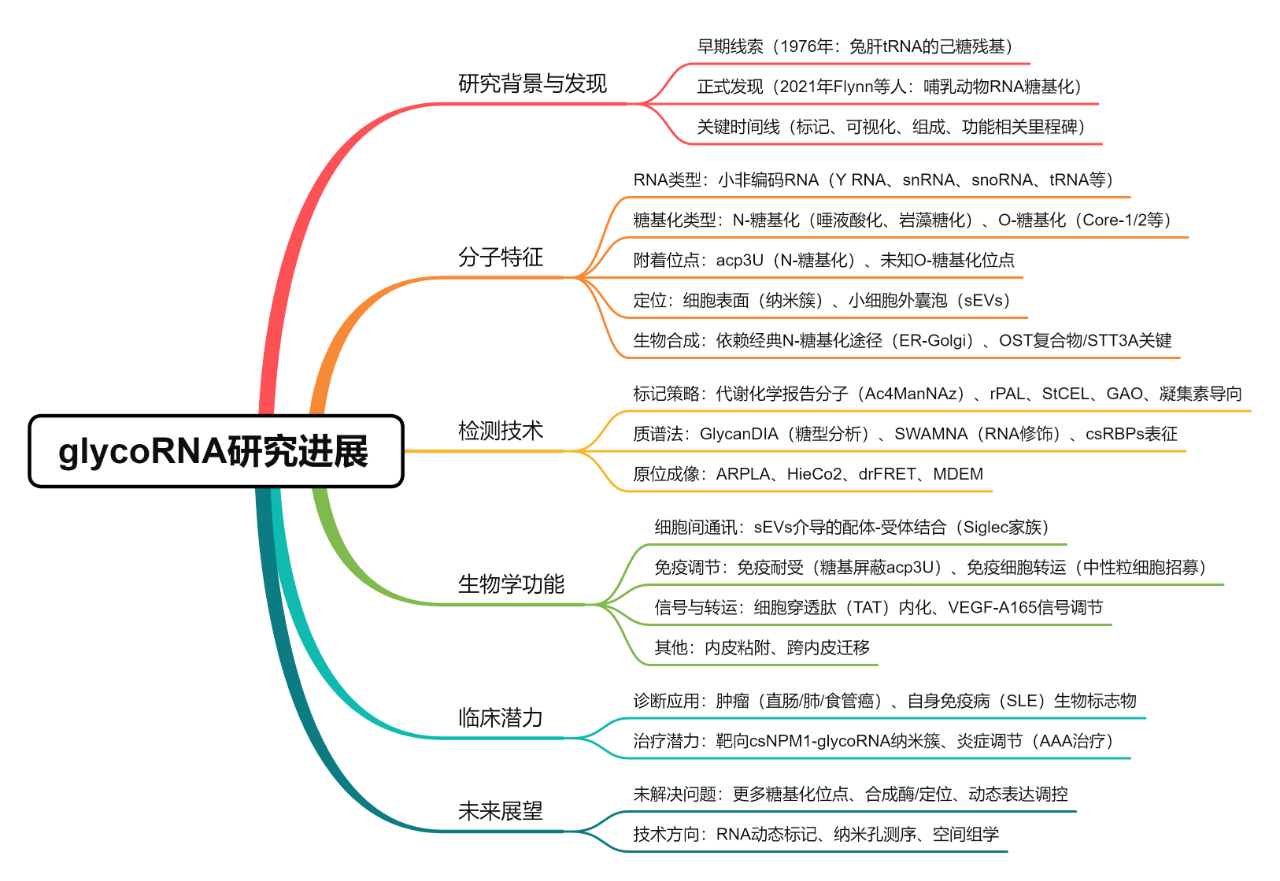
以上就是近些年glycoRNA研究领域发表的一些顶刊成果。最后,围绕复旦大学粤港澳大湾区精准医学研究院(广州)谢一轩课题组最新发表的综述文章[2],再概括下glycoRNA的研究进展:
glycoRNA的研究概况[2]
一、glycoRNA的发现与分子特征
发现于2021年,首次在哺乳动物细胞中鉴定出一类被N-聚糖修饰的小非编码RNA[3]。后续研究明确了其核心分子特征:
-
RNA类型:主要为小非编码RNA,如Y RNA、snRNA、snoRNA和tRNA等。
-
聚糖特征:携带高度唾液酸化和岩藻糖基化的复杂型N-聚糖。
-
关键修饰位点:2024年的研究利用rPAL技术结合质谱,鉴定出修饰碱基acp3U是N-聚糖在RNA上的共价连接位点。
-
细胞定位与组装:GlycoRNA主要定位于活细胞表面及小细胞外囊泡。在细胞表面,它们与细胞表面RNA结合蛋白及HSPG共同组装形成直径约120-150nm的纳米簇。
-
生物合成:依赖于经典的蛋白质N-糖基化机制(如OST复合物)和内质网-高尔基体运输途径。
二、glycoRNA检测技术
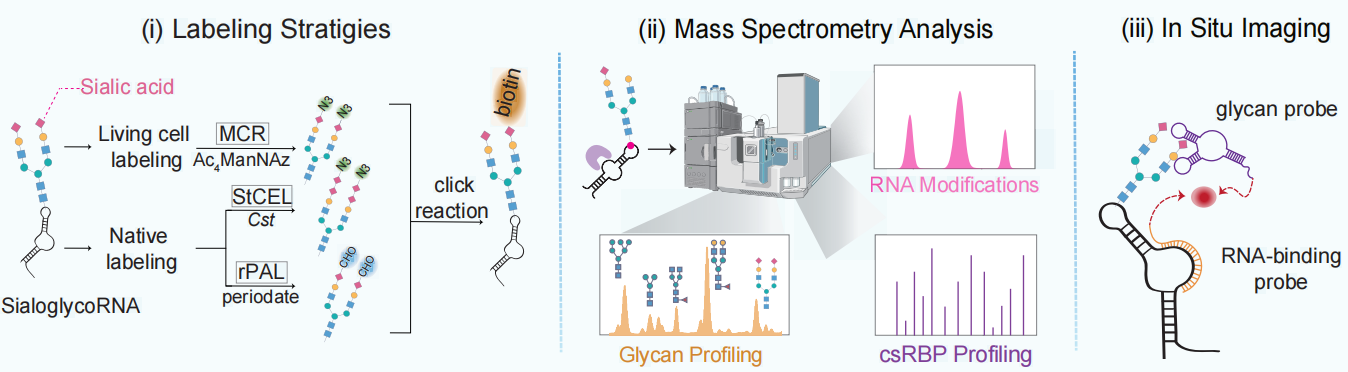
1. glycoRNA检测的标记策略
-
代谢化学报告分子(MCR):使用Ac4ManNAz等叠氮糖类似物进行代谢标记,是发现glycoRNA的基础方法。
-
rPAL技术:针对天然sialoglycoRNA开发的直接化学标记法,不依赖细胞代谢,灵敏度更高,适用于临床样本[9]。
-
酶介导的化学标记(StCEL):利用唾液酸转移酶(如CstII)将带有标签的唾液酸转移到天然glycoRNA上,实现了高通量定量检测[17]。
-
半乳糖氧化酶法(GAO):用于检测O-糖基化RNA。
-
凝集素引导的方法:利用生物素化凝集素进行印迹检测或邻近标记。
2.基于质谱(MS)的方法
为解决低丰度糖链的分析难题,研究开发了DIA流程——GlycanDIA。该方法结合优化的碎片离子库,能够高灵敏度、高精度地鉴定和定量N-聚糖、O-聚糖及人乳低聚糖,揭示了RNA上的糖链结构具有不同于蛋白糖修饰的特征(如高甘露糖型或特定的唾液酸/岩藻糖比例)[14]。
3. glycoRNA的原位成像
-
ARPLA:利用邻近连接分析(PLA)原理,仅当糖探针和RNA探针同时结合时才产生信号[7]。
-
HieCo2与双代谢标记:提高了检测的特异性和信噪比。
-
drFRET:适用于细胞外囊泡上glycoRNA的快速检测[13]。
三、glycoRNA的生物学功能
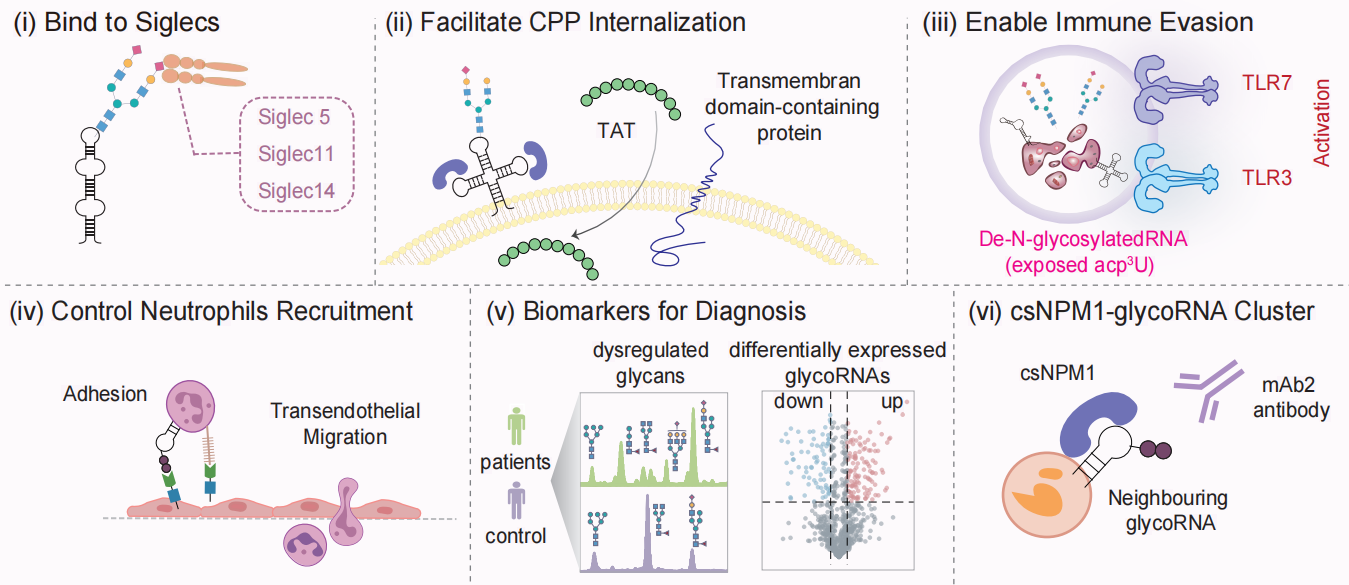
1. 与Siglec受体结合:
其表面的唾液酸化聚糖可作为配体,与免疫细胞表面的Siglec家族受体结合,参与免疫识别[3]。
2. 促进细胞穿透肽内化:
细胞表面的glycoRNA-csRBP-HSPG纳米簇可作为细胞穿透肽(如HIV TAT)进入细胞的位点[10]。
3. 实现免疫逃逸关键机制:
glycoRNA的N-聚糖像一个“分子盾牌”,物理屏蔽了下方的免疫刺激性碱基acp3U。在细胞凋亡和被清除(胞葬)过程中,完整的glycoRNA保持“免疫静默”;而去糖基化后暴露的acp3U会被内体中的TLR3/TLR7识别,触发I型干扰素和炎症反应,揭示了其在维持免疫稳态中的核心功能[15]。
4. 调控中性粒细胞招募:
内皮细胞上的glycoRNA能与P-selectin相互作用,调控中性粒细胞的粘附与迁移[8]。
5. 作为疾病诊断生物标志物:
在癌症患者血清来源的sEV上,特定的glycoRNA谱能高精度区分癌症与非癌症样本,并对多种癌症类型进行分类,展现出巨大的无创诊断潜力[13]。
6. 作为治疗靶点(csNPM1-glycoRNA Clusters):
在AML等模型中,肿瘤细胞表面特异性聚集的csNPM1-glycoRNA簇可被单克隆抗体识别,展现出治疗潜力[11]。
四、glycoRNA的临床潜力
1. 诊断效用
glycoRNA的表达水平和糖链结构在疾病状态下会发生显著变化。例如,在乳腺癌细胞中,表面glycoRNA丰度与恶性程度呈负相关;而在直肠癌、肺癌等组织中,唾液酸化glycoRNA水平显著升高。基于外泌体glycoRNA的液体活检技术有望用于癌症的早期诊断和分型。
2. 治疗潜力
细胞表面glycoRNA与蛋白(如NPM1)形成的复合物提供了特异性的治疗靶点。针对细胞表面NPM1的单克隆抗体在AML模型中显示出显著疗效。此外,利用glycoRNA修饰的纳米颗粒调节炎症也是潜在的治疗策略。
五、glycoRNA的未来展望
寻找除acp3U以外的N-糖基化位点及O-糖基化位点;解析glycoRNA生物合成的具体酶学机制和亚细胞定位;鉴定更多与glycoRNA结合的蛋白;以及深入探索其在生理和病理条件下的动态变化规律。这些研究将进一步推动RNA生物学与糖生物学的融合,并促进新型诊断和治疗方法的开发。
感谢您的耐心阅读,表观生物公众号会持续关注glycoRNA的研究动态,第一时间解读glycoRNA最新研究成果,欢迎表观生物公众号。
- - - 推荐阅读 - - -
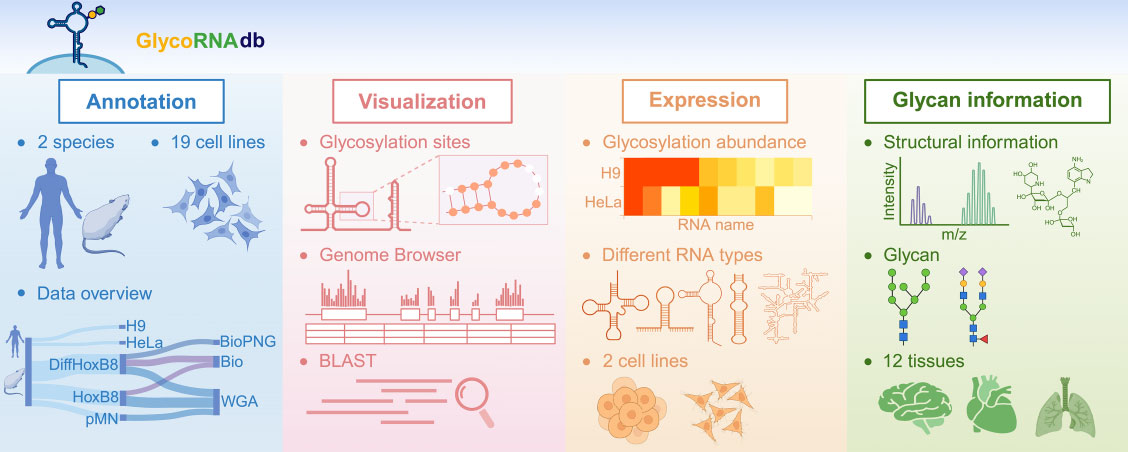
NAR | 首个glycoRNA多组学数据库“GlycoRNAdb”
尽管glycoRNA研究价值日益凸显,但相关数据仍然分散且缺乏系统整理。目前亟需一个集中的资源平台来整合序列、结构、修饰位点及表达信息,以推动这一新兴领域的深入研究。
2025-12-11

多组学案例丨RNA介导的TFE3癌融合蛋白相分离促进转录枢纽形成,推动易位性肾细胞癌进展
且越来越多的研究表明,癌基因融合蛋白可通过相分离形成凝聚体,从而重塑转录输出。尤其是,TFE3的多个融合伴侣(约57%)是RNA结合蛋白(RBP),暗示RNA介导的多价相互作用可能在TFE3融合蛋白凝聚体形成中发挥关键作用。然而,RNA与RBP如何协同调控TFE3融合癌蛋白的相分离行为,以及这种相分离如何特异性地驱动致癌转录程序,仍是未解决的重要科学问题。此外,靶向癌蛋白凝聚体作为治疗策略的可行性也亟待验证。
2025-12-11

NAR丨SEA version 4.0:超级增强子数据库重大升级,跨物种解析基因调控
未来,团队计划进一步整合空间转录组与单细胞表观组数据,构建更高精度的细胞水平SE活动图谱,持续推动基因调控机制的解析。
2025-12-11
