Cell | 靶向TFAP2β相分离抑制食管鳞癌发展
食管鳞状细胞癌(ESCC)主要由食管鳞状上皮发生恶性转化而来,其发病隐匿且侵袭性强,是全球范围内致死率极高的消化道肿瘤。尽管基因组学研究已揭示了多种驱动突变,但转录因子介导的表观遗传重塑在ESCC早期发生中的核心机制仍未被完全阐明。LLPS(液-液相分离)作为一种细胞内无膜细胞器的组装形式,被发现是转录调控的新型物理基础。许多关键转录因子通过其内在无序区发生相分离,构建高浓度的转录枢纽以精确调控下游基因表达。然而,在ESCC尤其是早期病变中,是否存在特异性的转录因子利用LLPS机制调控染色质状态?这种物理化学性质的改变如何影响肿瘤的发生发展?能否开发针对LLPS的小分子药物以突破传统“不可成药”靶点的治疗瓶颈?
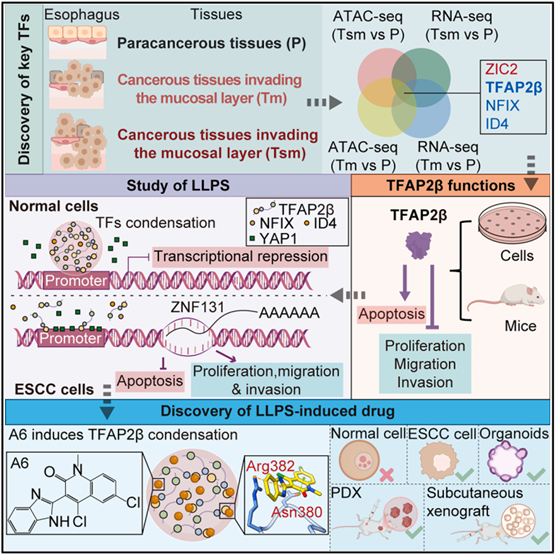

2025 年 12 月16 日,四川大学华西医院消化内科姜昊/杨锦林/杨丽、牛津大学DavidJ. Kerr和华西医院麻醉学研究所柯博文作为共同通讯作者,在《Cell》期刊发表了题为“Targeting TFAP2β condensation suppresses the development of esophageal squamous cell carcinoma”的研究论文。该研究揭示了转录因子TFAP2β在ESCC早期的染色质可及性下调,并证实其通过相分离形成转录抑制枢纽,招募NFIX和ID4以抑制癌基因ZNF131的表达。此外,通过虚拟筛选发现了一种小分子化合物A6,能够特异性诱导并增强TFAP2β的相分离,从而恢复其抑癌功能,在细胞、类器官和PDX模型中显著抑制ESCC进展。
技术路线图
关键研究结果
1. 多组学联合分析锁定 TFAP2β 为 ESCC 关键抑癌因子
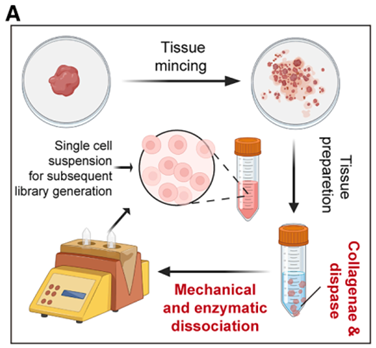
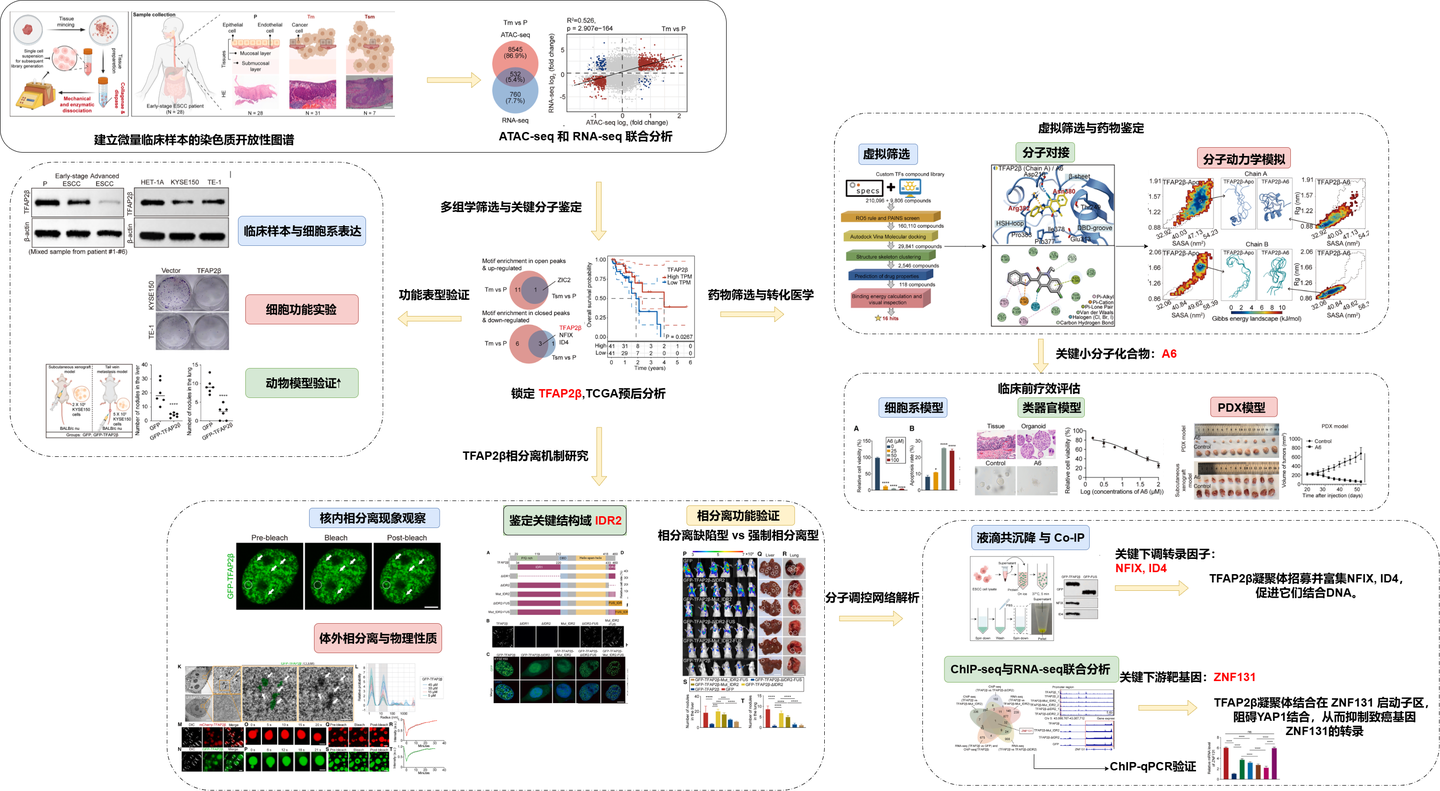
研究团队针对早期食管鳞癌临床微量样本,优化了 ATAC-seq 实验流程,通过胶原酶与分散酶的协同消化,将病理组织的建库成功率大幅提升。
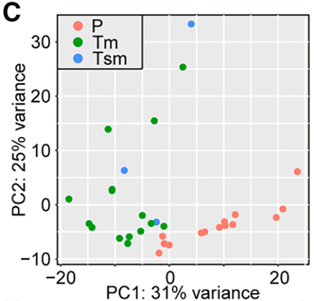
基于对 28 名患者共 66 份配对样本(旁侧组织 P、黏膜内癌 Tm、黏膜下癌 Tsm)的染色质开放性和基因表达谱分析,PCA 结果显示,随着疾病从正常组织向黏膜内癌及黏膜下癌进展,染色质景观发生了显著且连续的变化。
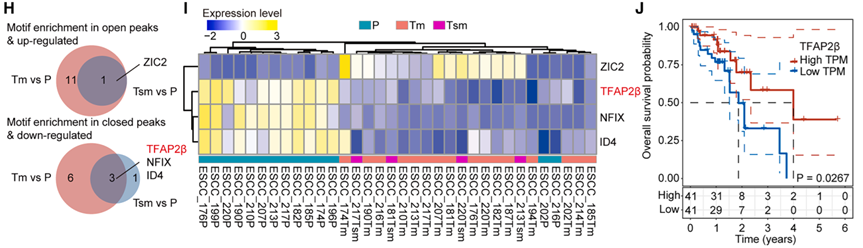
通过对差异开放峰和差异表达基因的交叉筛选,研究团队鉴定出 TFAP2β 是 ESCC 进展过程中最关键的下调转录因子之一。进一步的生存分析验证了 TFAP2β 的临床价值:其低表达与食管癌患者的预后不良和生存期缩短显著相关。这一结果打破了以往对致癌因子的单一关注,确立了 TFAP2β 在食管鳞癌早期发生中作为核心抑癌因子的地位,为其作为早期诊断标志物提供了坚实的理论支撑。
2. 体内外功能实验证实 TFAP2β 具有显著的抑癌活性
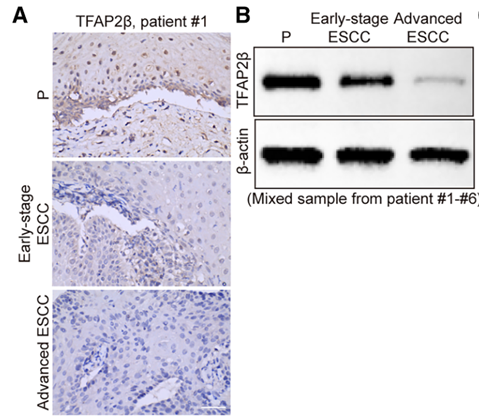
为了明确 TFAP2β 的生物学功能,研究团队首先观察到其蛋白表达随 ESCC 恶性程度增加而逐级降低。
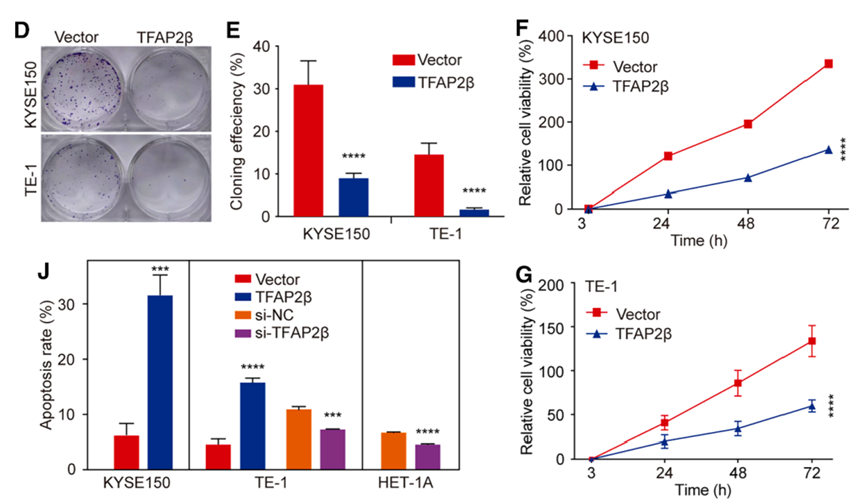
在功能层面,通过在 KYSE150和 TE-1 细胞系中过表达 TFAP2β,实验结果显示克隆形成能力显著下降,细胞增殖速率明显减缓。流式细胞术检测结果发现,TFAP2β 的高表达能够诱导显著的细胞凋亡。
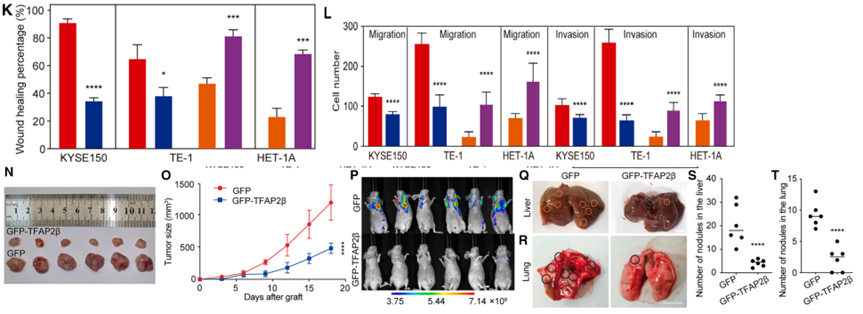
此外,Transwell 实验证实 TFAP2β 能够强烈抑制 ESCC 细胞的迁移与侵袭。为了模拟体内环境,研究团队构建了皮下异种移植瘤和尾静脉转移模型。结果显示,过表达 TFAP2β 的小鼠肿瘤生长受阻,体积和重量均显著减小;同时,肺部及肝部的转移结节数量大幅度下降。这些详尽的数据明确了 TFAP2β 是一个强效的抑癌蛋白,其表达丢失是驱动食管癌细胞恶性增殖和远程转移的关键因素,为后续探索其作用机制奠定了生物学基础。
3. TFAP2β 通过LLPS形成动态核凝聚体
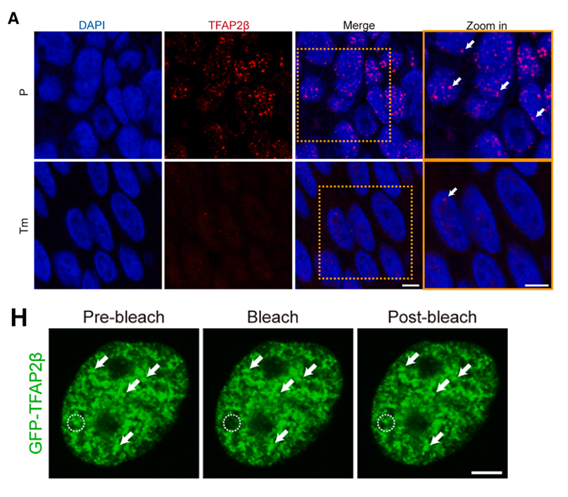
机制研究揭示了 TFAP2β 发挥功能的物理基础。序列分析预测发现 TFAP2β 包含高度无序的固有无序区,具备形成凝聚体的结构潜力。通过活细胞荧光成像,研究者观察到 TFAP2β 在细胞核内形成了明显的 puncta(小点状结构)。

随后的FRAP(光漂白恢复)实验证实,这些 puncta 具有高度的内部动态性和分子交换能力,符合LLPS的典型物理特征。而且,TFAP2β 在正常食管上皮细胞中的凝聚能力显著强于癌细胞,且随着 1,6-HD(1,6-己二醇)的加入,凝聚体会迅速消失,证明这种聚集是可逆的疏水相互作用驱动的。这一发现揭示了 TFAP2β 并非以游离单体形式起作用,而是通过 LLPS 形成生物大分子凝聚体,为其在细胞核内精准调控转录提供了物理平台。
4. IDR2 结构域是 TFAP2β 凝聚及抑癌功能的关键核心
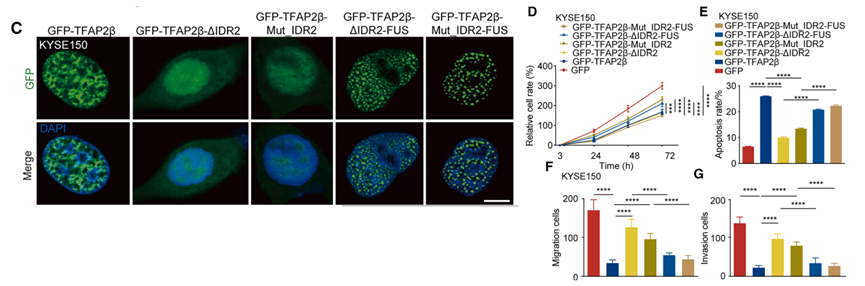
研究团队进一步探索了 TFAP2β 形成相分离的分子基序,发现其包含三个主要的 IDR 区域。缺失实验表明,IDR2 区域对于 TFAP2β 凝聚体的形成至关重要;缺失 IDR2 或对其关键氨基酸进行突变(Mut_IDR2)后,蛋白在核内的分布变得弥散,凝聚能力几乎丧失。
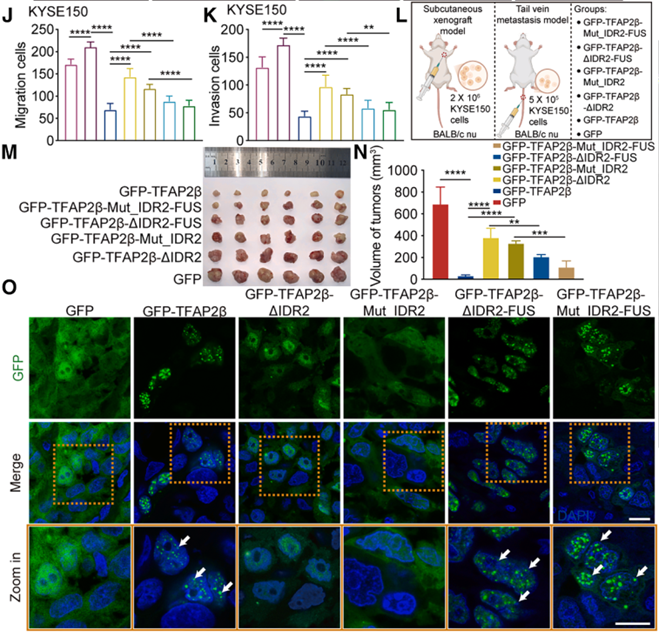
功能实验结果显示,这些凝聚能力缺失的突变体也失去了抑制癌细胞增殖和诱导凋亡的能力。为了证明凝聚本身是其功能的基础,研究团队利用人工合成的 FUS-IDR 片段与 TFAP2β 突变体融合。结果发现,通过这种方式强行恢复物理凝聚能力后,其抗肿瘤活性也随之得到了挽救。这一关键证据确立了 TFAP2β 相分离的物理形态与其抑癌活性的生物学功能之间的因果关联,证明 IDR2 介导的凝聚是其执行抑癌程序的结构开关。
5. TFAP2β 凝聚体作为平台协同抑制原癌基因 ZNF131 转录
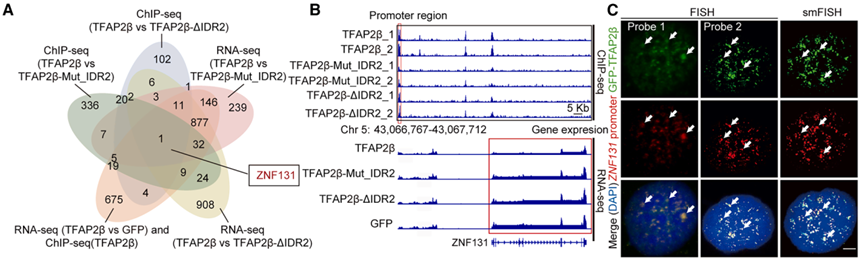
在分子机理上,研究团队通过ChIP-seq 与 RNA-seq 整合分析发现,TFAP2β 凝聚体特异性地招募了其他下调的转录因子 NFIX 和 ID4,形成一个共定位的多蛋白复合体。
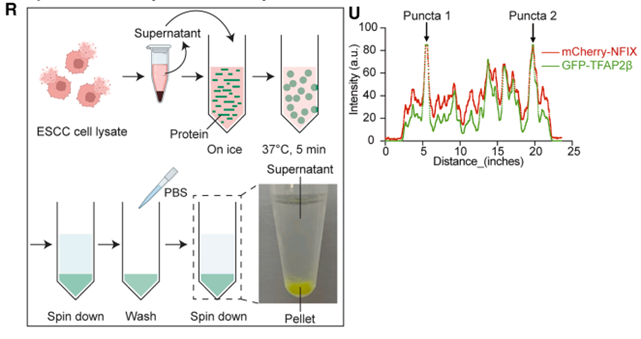
该复合体通过相分离形成的“微环境”,显著增强了其对下游靶基因的调控效能。研究证实,TFAP2β 凝聚体直接结合在原癌基因 ZNF131 的启动子区域,并对其转录产生强烈的抑制作用。此外,TFAP2β 还能抑制 YAP1 等其他致癌因子的表达。这种通过 LLPS 招募协同因子并建立转录抑制平台的模式,解释了 TFAP2β 如何高效地抑制食管癌的恶性程序。实验进一步证明,当 ZNF131 被过表达时,TFAP2β 的抑癌作用会被部分抵消,从而锁定了 ZNF131 是 TFAP2β 凝聚体调控的最核心下游靶点,揭示了食管癌发生中关键的转录重编程机制。
6. 小分子化合物 A6 能够靶向诱导并增强 TFAP2β 相分离
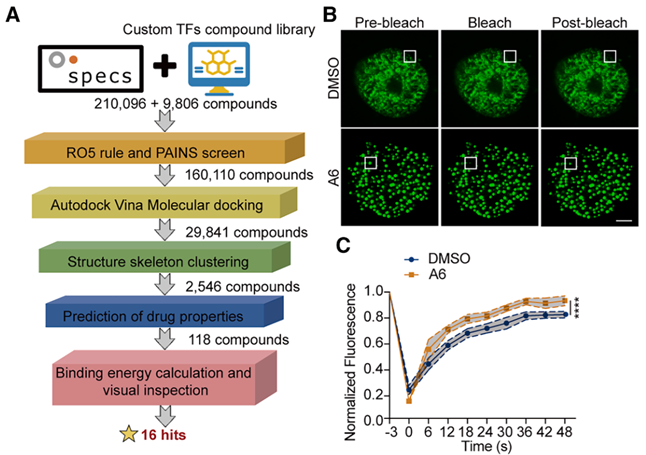
鉴于 TFAP2β 凝聚在抑癌中的核心作用,研究者试图寻找能增强这一过程的药物。通过大规模虚拟筛选和物理验证,鉴定出小分子化合物A6。实验显示,A6 能以剂量依赖的方式显著诱导并增强 TFAP2β 的相分离,使 puncta 数量更多、体积更大。
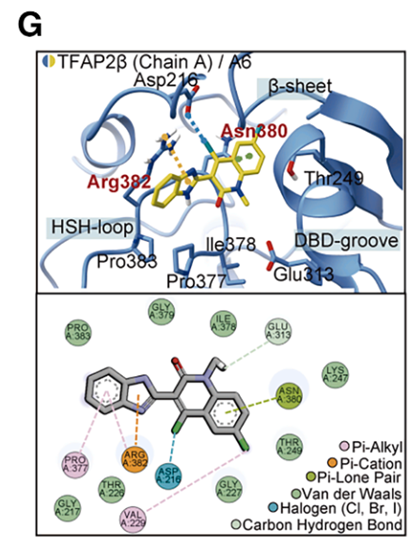
分子动力学模拟和氢氘交换质谱(HDX-MS)分析表明,A6 直接与 TFAP2β 的Arg382 和 Asn380 残基相互作用,通过改变蛋白构象降低了相分离的临界浓度。体外实验证实,A6 的加入能使原本不发生相分离的低浓度 TFAP2β 迅速形成液滴。这种通过化学小分子诱导转录因子重新凝聚的策略,为针对“不可药用”转录因子的干预提供了创新思路,即通过物理状态的调节而非单纯的活性位点抑制来实现治疗目的。
7. 化合物 A6 在多种临床前模型中展现卓越治疗潜力
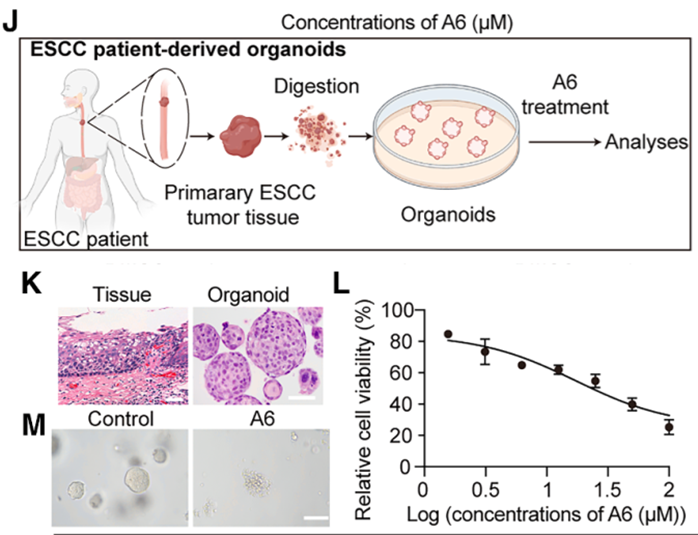
最后,研究团队评估了 A6 的临床转化价值。在多种 ESCC 细胞系中,A6 均能有效抑制细胞活力并诱导凋亡,且其杀伤效果严格依赖于 TFAP2β 的表达。
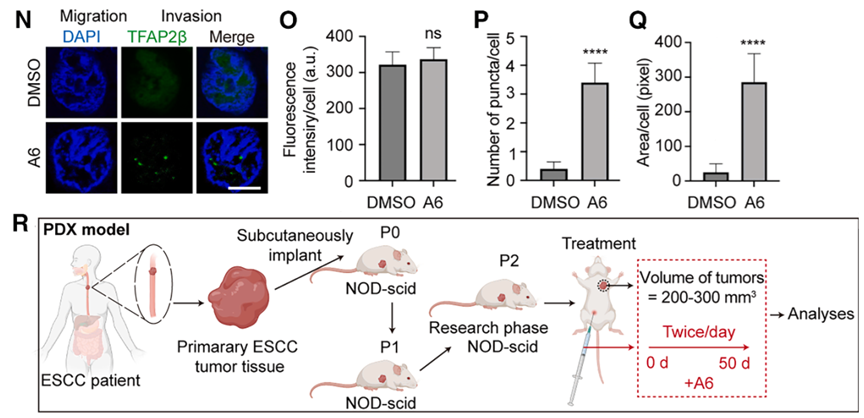
而且,在PDO(患者来源的肿瘤类器官)以及PDX 小鼠模型中,A6 治疗组的肿瘤生长受到了极大限制,肿瘤体积缩小且内部出现大规模坏死。
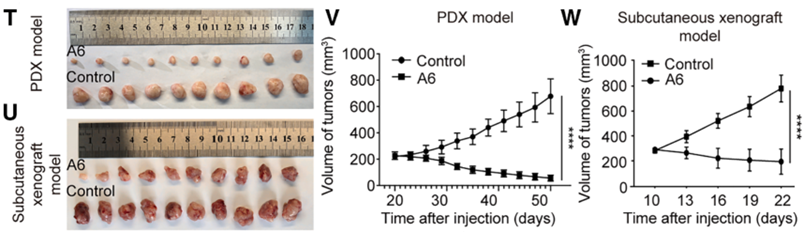
在安全性评估方面,长期服用 A6 的小鼠体重保持稳定,血常规及肝肾功能指标均在正常范围,重要脏器无明显病理损伤。这表明A6 是一种高效、低毒的 TFAP2β 凝聚诱导剂。该研究不仅揭示了 ESCC 发生的新机制,还从临床样本出发,完成了“机制发现-靶点鉴定-小分子筛选-体内外验证”的完整转化医学闭环,为食管鳞癌提供了全新的潜在治疗手段。
文章小结
该研究首先强调了在方法学上的突破,通过优化酶解消化步骤,显著提升了微量临床样本ATAC-seq建库的成功率,为早期癌症及稀有样本的表观遗传学研究提供了强有力的工具。在分子机制层面,该研究总结了TFAP2β相分离在调控ESCC转录中的双重抑癌模式:一方面,TFAP2β凝聚体通过占据ZNF131启动子区域,竞争性阻断转录激活因子YAP1的结合,从而直接抑制促癌基因表达;另一方面,该凝聚体作为分子平台,招募并富集NFIX和ID4,增强了这些转录因子与DNA的结合能力以协同发挥抑癌作用。此外,研究还阐明了小分子化合物A6的转化价值,证实其能通过特异性结合TFAP2β并诱导构象改变来增强其相分离能力,进而在细胞系、类器官及PDX模型中有效抑制肿瘤进展。尽管多蛋白共凝聚的精细调控网络及药物的药代动力学特性仍有待深入探索,但这项工作确立了通过药物诱导恢复抑癌蛋白相分离作为ESCC治疗新策略的可行性。
- - - 推荐阅读 - - -
一文梳理糖基化RNA研究领域的演进,顶刊成果全回顾
2025-12-23
NAR | 首个glycoRNA多组学数据库“GlycoRNAdb”
尽管glycoRNA研究价值日益凸显,但相关数据仍然分散且缺乏系统整理。目前亟需一个集中的资源平台来整合序列、结构、修饰位点及表达信息,以推动这一新兴领域的深入研究。
2025-12-11

多组学案例丨RNA介导的TFE3癌融合蛋白相分离促进转录枢纽形成,推动易位性肾细胞癌进展
且越来越多的研究表明,癌基因融合蛋白可通过相分离形成凝聚体,从而重塑转录输出。尤其是,TFE3的多个融合伴侣(约57%)是RNA结合蛋白(RBP),暗示RNA介导的多价相互作用可能在TFE3融合蛋白凝聚体形成中发挥关键作用。然而,RNA与RBP如何协同调控TFE3融合癌蛋白的相分离行为,以及这种相分离如何特异性地驱动致癌转录程序,仍是未解决的重要科学问题。此外,靶向癌蛋白凝聚体作为治疗策略的可行性也亟待验证。
2025-12-11
