多组学案例丨RNA介导的TFE3癌融合蛋白相分离促进转录枢纽形成,推动易位性肾细胞癌进展

2025年9月,德州农工大学黄韵、周育斌团队在《Nature Communications》期刊发表了题为“RNA-mediated condensation of TFE3 oncofusions facilitates transcriptional hub formation to promote translocation renal cell carcinoma”的研究论文。该研究确立了RNA介导的相分离是TFE3融合蛋白驱动tRCC进展的核心机制。研究表明,TFE3融合伴侣中的RNA结合结构域与TFE3的内在无序区(IDR)协同作用,驱动相分离形成。这一过程招募了PSPC1和RNAPII(RNA聚合酶II),构建了高效的转录延伸枢纽,激活了HK2和RRM2等代谢及细胞周期相关基因。此外,开发了一种基于分裂纳米体和麦芽糖结合蛋白的化学遗传学工具,能够特异性溶解这些凝聚体,从而阻断肿瘤生长,验证了其作为治疗靶点的潜力。
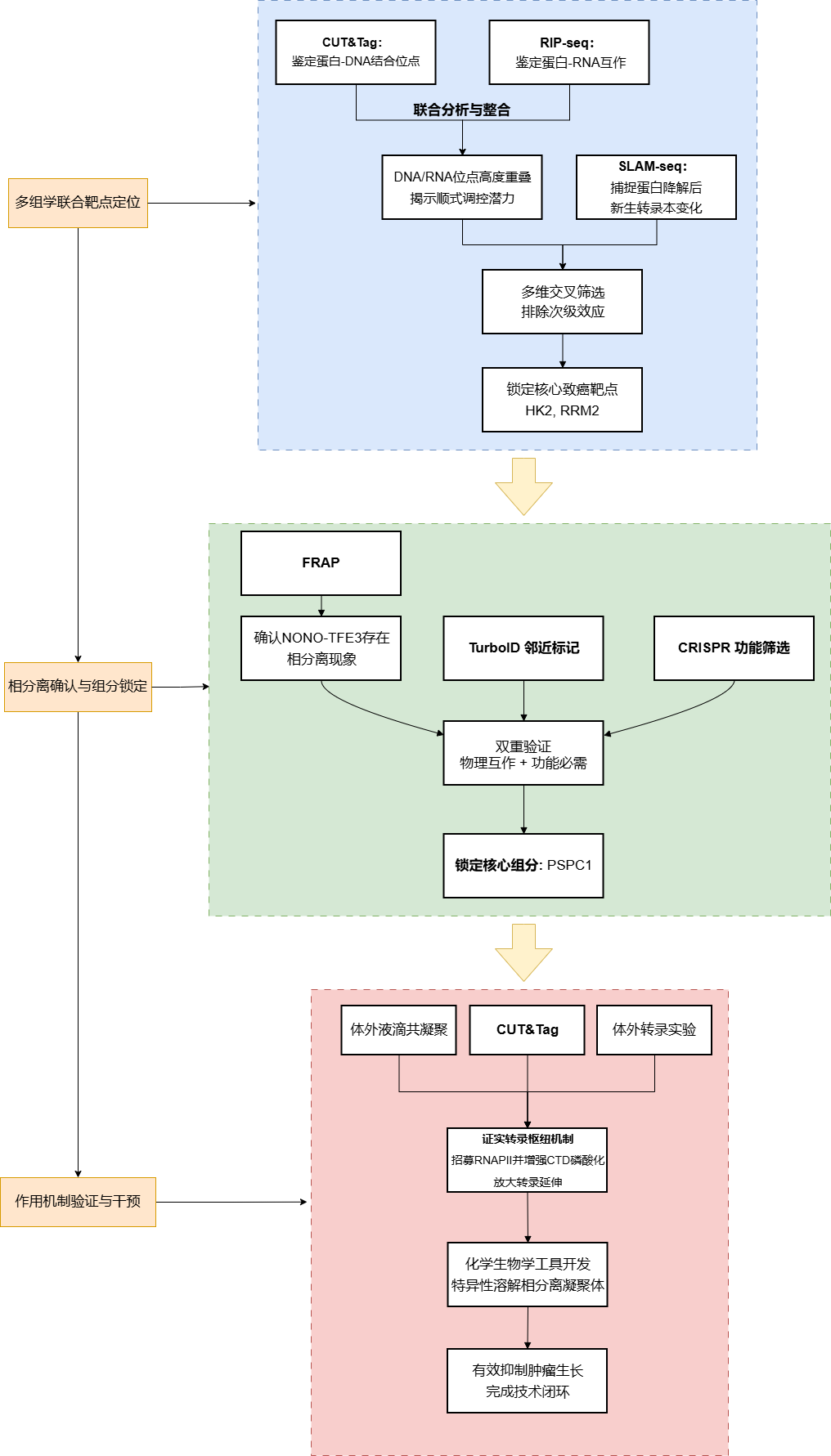
1. NONO-TFE3具备双重DNA/RNA结合能力并建立顺式调控反馈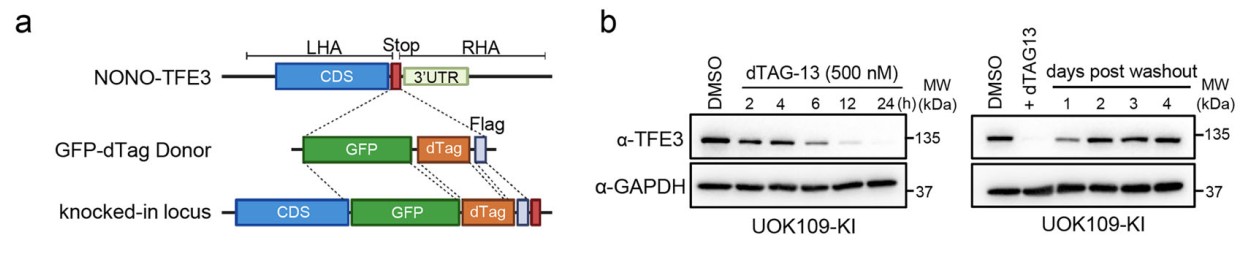
研究团队首先通过CRISPR敲入在UOK109患者来源细胞系中构建了内源性GFP-dTAG-Flag标记的NONO-TFE3系统,实现了对该癌融合蛋白的快速诱导降解。

通过CUT&Tag和RIP-seq的联合分析,研究发现NONO-TFE3不仅结合基因组上的启动子区域,还与大量新生RNA相互作用,且约40%的RNA结合位点与其DNA结合区域重叠。
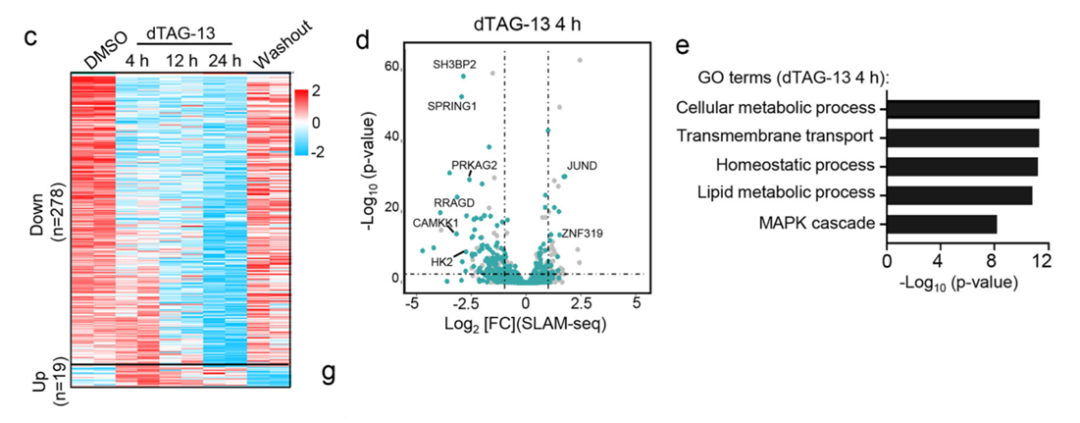
为了探究其转录调控功能,研究采用了SLAM-seq技术测定新生转录本,发现NONO-TFE3的降解导致一系列涉及细胞代谢、脂质代谢及MAPK级联通路的基因显著下调。
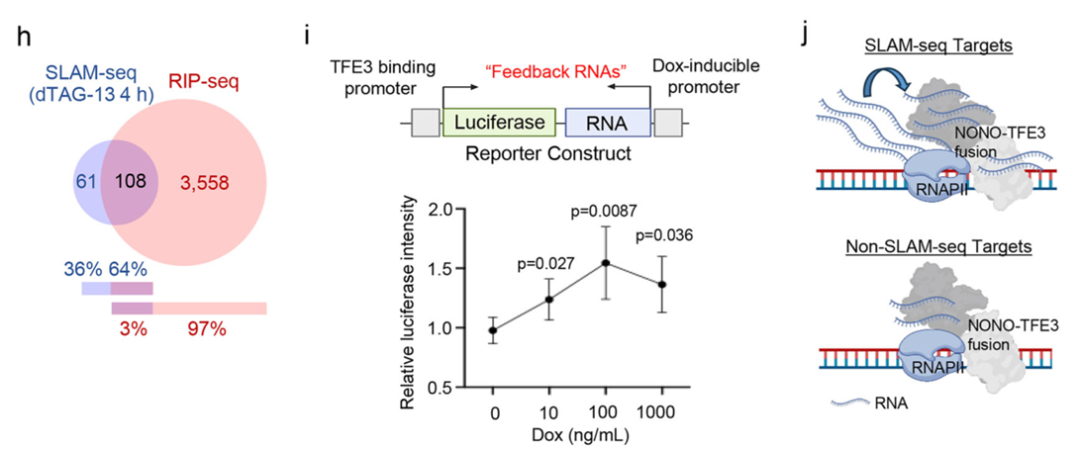
约有64%的NONO-TFE3靶基因在其转录本上也存在NONO-TFE3的RNA结合峰,且这些具有双重结合特征的基因表达水平更高,这提示NONO-TFE3可能通过结合新生RNA形成顺式调控反馈回路,从而维持其在靶基因位点的高转录活性。
2. 融合伴侣赋予的RNA结合能力是驱动TFE3癌蛋白相分离的核心机制
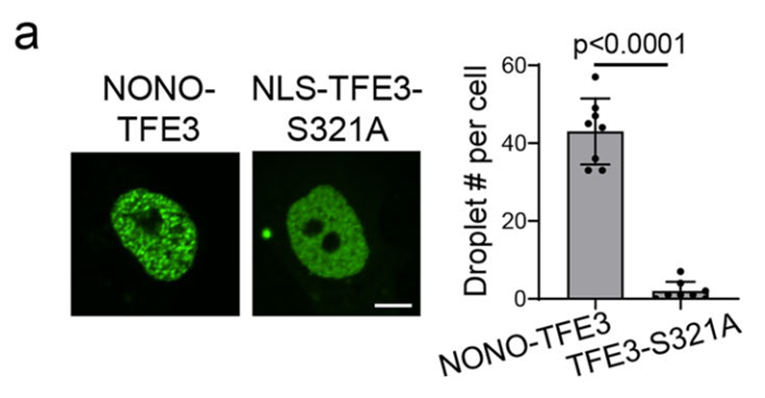
利用FRAP和活细胞成像技术,研究观察到NONO-TFE3在细胞核内能形成明显的LLPS凝聚体,而缺乏融合伴侣的野生型TFE3(核定位突变体NLS-TFE3-S321A)则呈弥散分布。
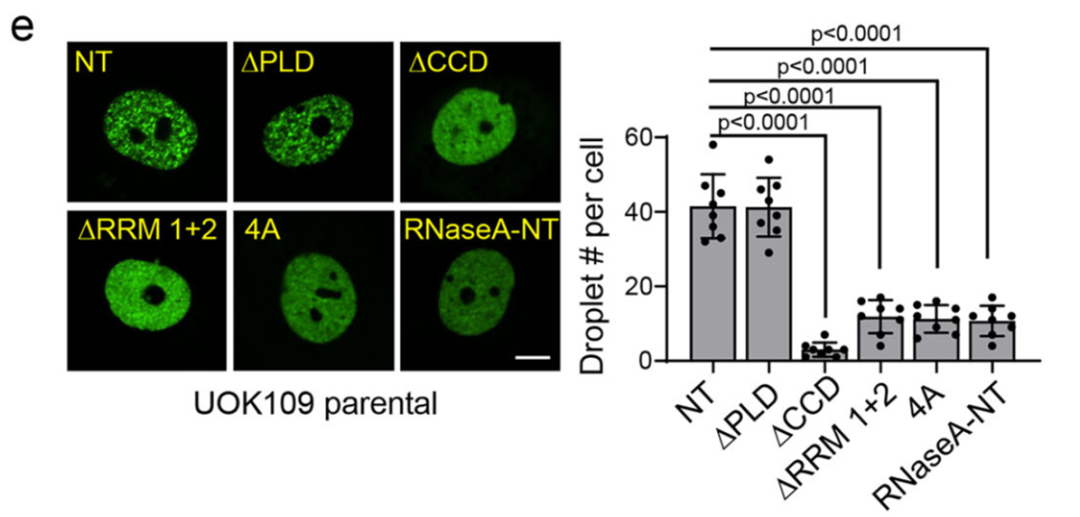
通过构建一系列截短突变体,研究发现NONO部分的螺旋-螺旋结构域和RNA识别基序(RRM)对凝聚体形成至关重要;特别是将RRM结构域的关键氨基酸突变或使用RNase A处理以清除RNA,均会导致凝聚体完全消失。
此外,LacO阵列实验进一步证实,只有具备RNA 结合能力的NONO-TFE3才能在染色质特定位点形成高浓度的蛋白枢纽。
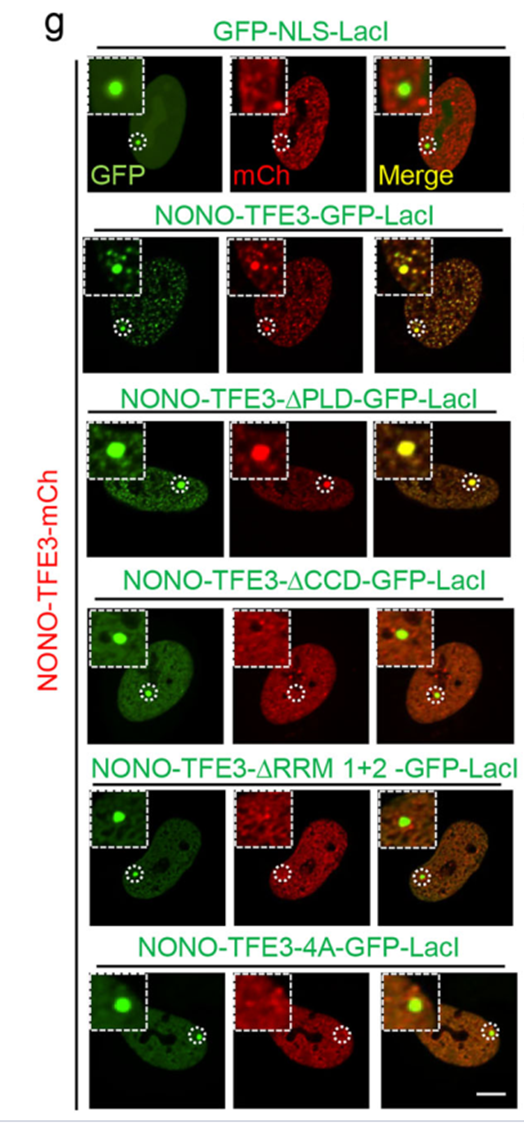
这些结果确立了TFE3融合蛋白通过获得融合伴侣的RNA结合能力,利用RNA作为多价相互作用的支架来驱动相分离的机制。
3. PSPC1被招募至相分离凝聚体中以构建转录枢纽
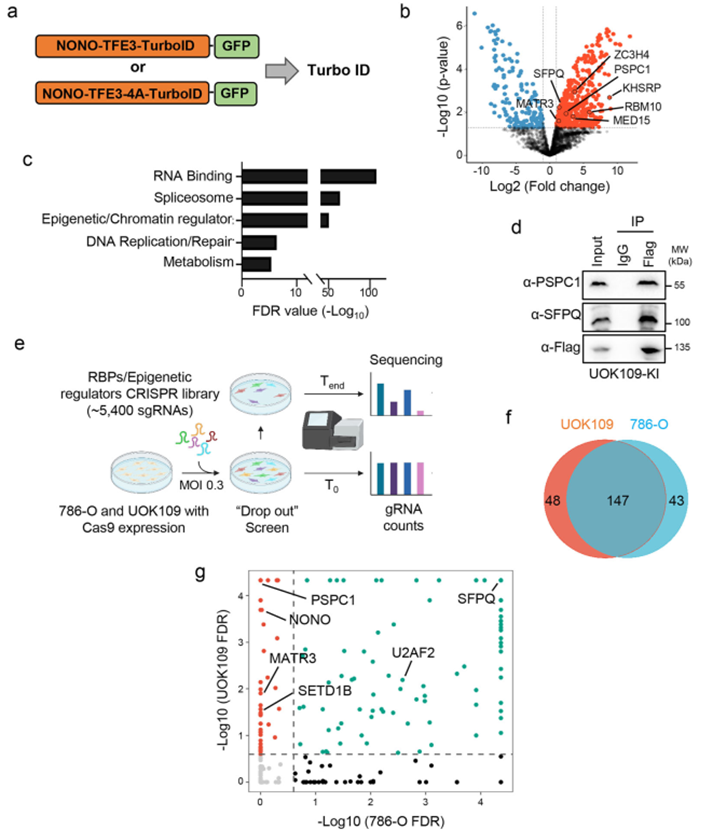
为了解析NONO-TFE3凝聚体的分子组成,研究利用TurboID邻近标记技术结合CRISPR功能基因组学筛选,鉴定出RBP PSPC1是NONO-TFE3的关键互作伙伴,且对tRCC细胞的存活至关重要。
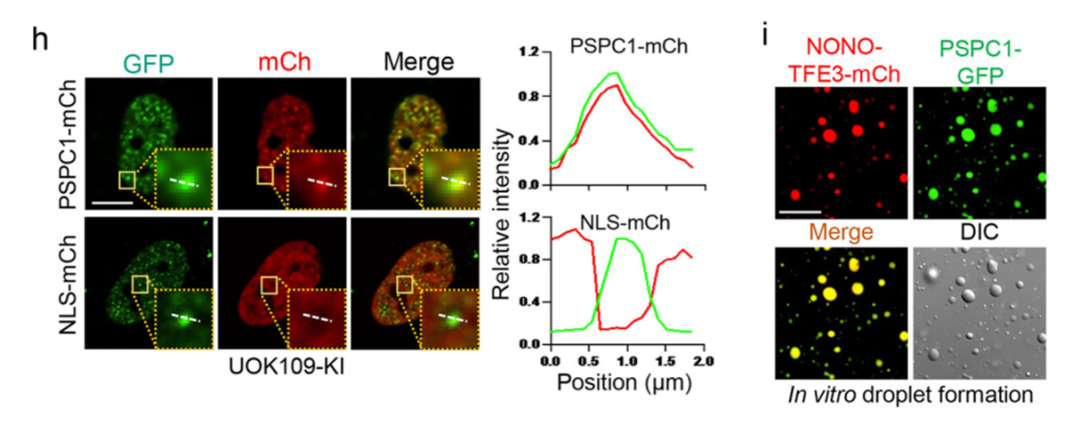
显微成像显示PSPC1与NONO-TFE3在细胞核内高度共定位并形成共凝聚体,而这种共凝聚依赖于RNA的存在。
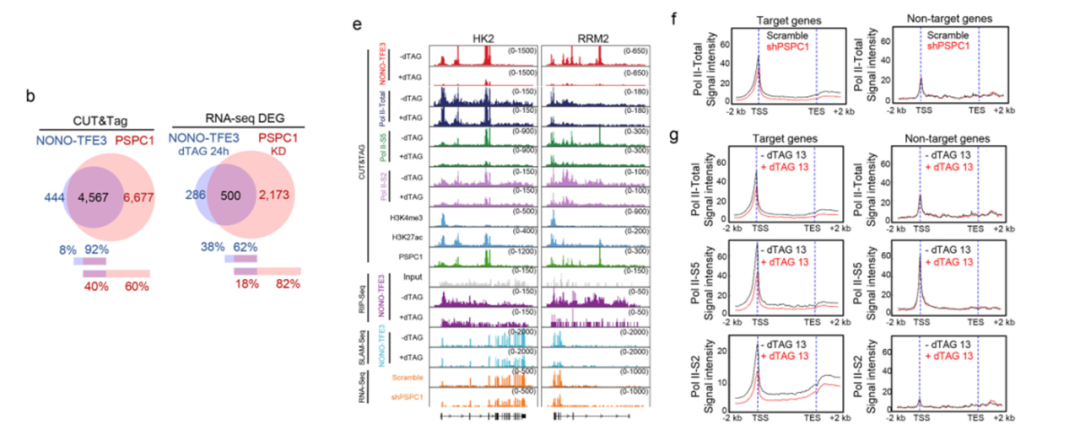
机制研究表明,PSPC1在染色质上的结合高度依赖于NONO-TFE3;敲低PSPC1会显著降低RNAPII,特别是其磷酸化活性形式在NONO-TFE3靶基因上的招募与富集,进而抑制这些促癌基因的转录。表明NONO-TFE3利用相分离构建了一个包含PSPC1的转录枢纽,以促进RNAPII的有效加载和延伸。
4. RNA与PSPC1协同调节凝聚体内的RNAPII磷酸化与转录活性
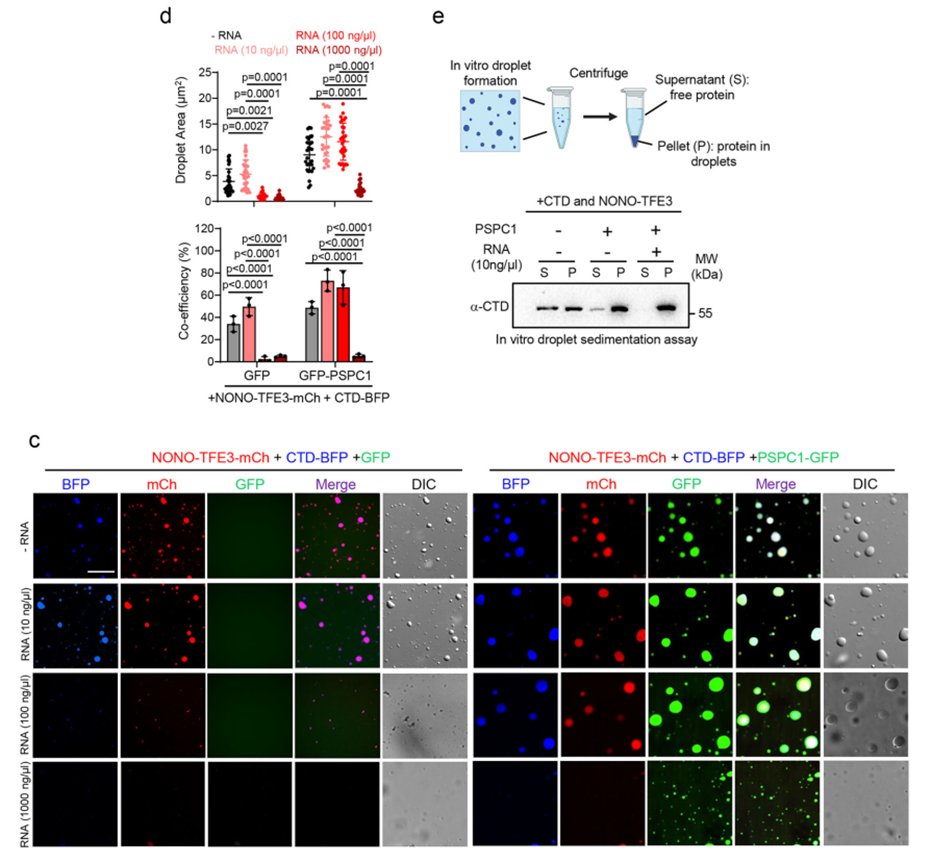
体外重组蛋白液滴实验揭示了RNA浓度对相分离的精细调控:低浓度RNA促进NONO-TFE3与RNAPII CTD的共凝聚,而高浓度RNA则通过电荷排斥导致液滴解聚;PSPC1的加入能够中和RNA的负电荷,稳定凝聚体并显著扩大液滴体积。

在功能上,体外激酶分析和转录实验证明,在含有NONO-TFE3、PSPC1和适量RNA的相分离液滴环境中,CDK7对RNAPII CTD的磷酸化效率显著提升,转录产出增加了3倍以上。
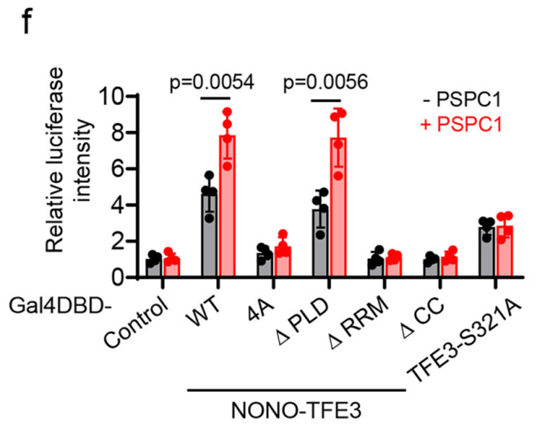
荧光素酶报告基因实验也证实,破坏相分离能力完全消除了这种转录增强效应。这些数据支持了一个模型:RNA介导的相分离通过富集酶和底物,创造了一个高效的生化反应环境来驱动转录。
5. 化学遗传学强制解聚癌融合蛋白凝聚体可有效抑制肿瘤生长
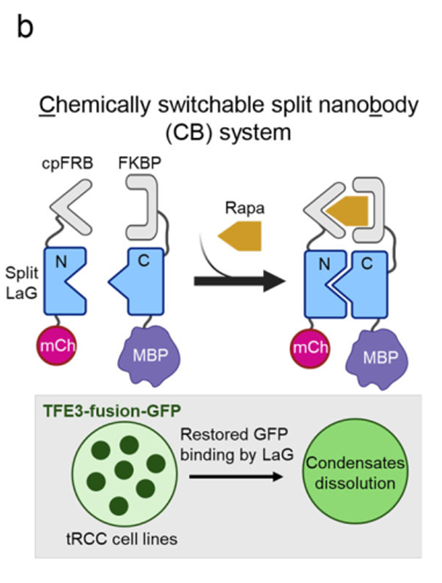
基于相分离对tRCC致癌性的关键作用,研究团队开发了一种名为“Chessbody”的化学遗传学工具。该系统利用分裂纳米体,通过雷帕霉素(Rapamycin)诱导,将具有破坏相分离能力的麦芽糖结合蛋白(MBP)特异性招募至GFP标记的NONO-TFE3上。

实验结果显示,MBP的招募成功溶解了细胞核内的NONO-TFE3凝聚体。

这种强制解聚在转录组水平上导致了与直接降解NONO-TFE3高度一致的基因表达变化,并在体外集落形成实验和小鼠异种移植模型中显著抑制了tRCC肿瘤的生长。这一结果不仅在功能上验证了相分离的致癌必要性,也为靶向“不可成药”的转录因子凝聚体提供了新的治疗策略验证。
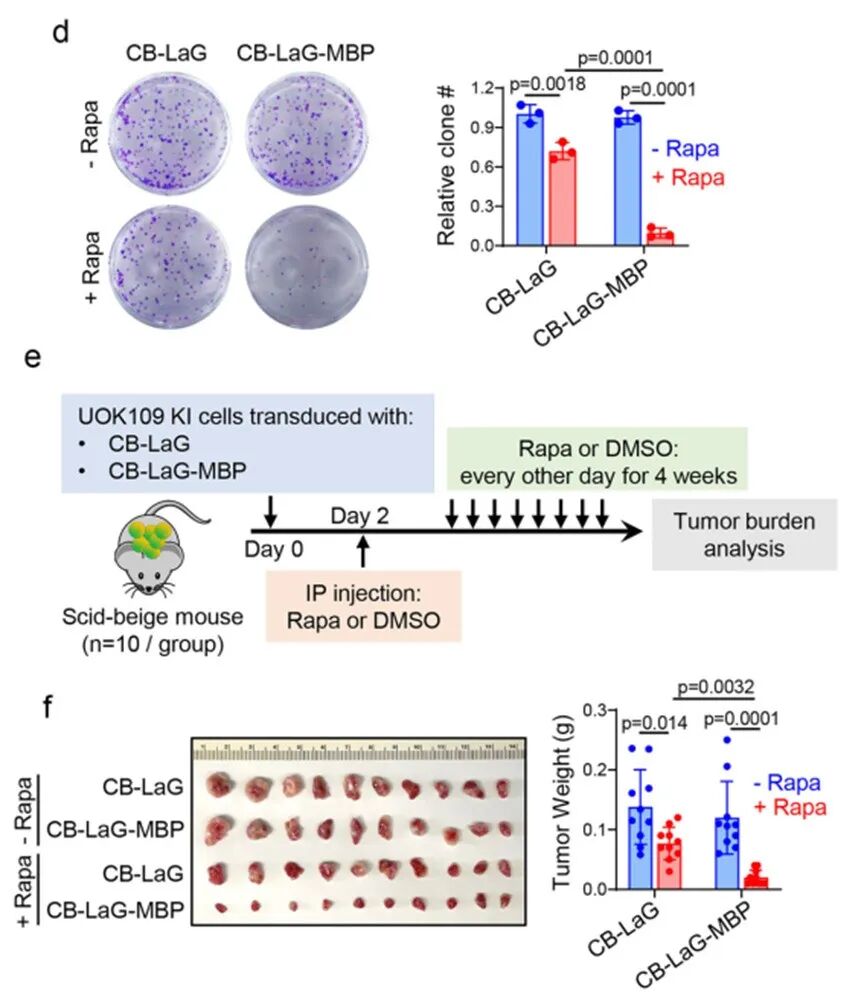
并在体外集落形成实验和小鼠异种移植模型中显著抑制了tRCC肿瘤的生长。这一结果不仅在功能上验证了相分离的致癌必要性,也为靶向“不可成药”的转录因子凝聚体提供了新的治疗策略验证。
该研究挑战了传统观点,强调TFE3融合伴侣中有序的RRM是驱动NONO-TFE3凝聚体形成的关键,而非通常认为的IDR。这揭示了TFE3癌融合蛋白相分离机制的独特性。研究提出了一个致癌模型:新转录的RNA可能通过一个反馈环路影响TFE3融合蛋白的转录活性,从而不断增强致癌信号。通过邻近蛋白质组学,推测“RNA和RBP介导的转录共凝聚”机制可能是所有TFE3融合蛋白驱动tRCC肿瘤的普遍致病机制。最后,鉴于通过化学遗传学方法破坏TFE3凝聚体能有效抑制tRCC细胞生长,这为靶向致癌凝聚体,特别是针对其核心RNA结合能力的策略,提供了有前景的新治疗方向。
参考文献:
[1] Guo L, Zhao R, Lee YT, et al. RNA-mediated condensation of TFE3 oncofusions facilitates transcriptional hub formation to promote translocation renal cell carcinoma. Nat Commun. 2025;16(1):8712. Published 2025 Sep 30. doi:10.1038/s41467-025-63761-zIF: 15.7 Q1 B1
- - - 推荐阅读 - - -

NAR丨SEA version 4.0:超级增强子数据库重大升级,跨物种解析基因调控
未来,团队计划进一步整合空间转录组与单细胞表观组数据,构建更高精度的细胞水平SE活动图谱,持续推动基因调控机制的解析。
2025-12-11

Cell Genom | 如何利用三维基因组图谱和机器学习识别胰腺疾病的驱动增强子
通过CRISPRi技术抑制该增强子的活性,他们成功地在原代腺泡细胞中观察到XBP1基因转录水平的显著下降,从而证实了该风险位点与靶基因之间的功能联系。
2025-11-26

Molecular Cell | 缺氧诱导ZHX2相分离改变染色质环,驱动癌症转移
转录因子ZHX2(zinc fingers and homeoboxes 2)是一个新近被发现的VHL底物,它可以通过HIF依赖和非依赖的方式激活癌基因,驱动肿瘤恶性进展。
2025-11-26
