Molecular Cell | 缺氧诱导ZHX2相分离改变染色质环,驱动癌症转移
缺氧是否调控与转录相关的相分离仍是未知的。在实体瘤中,缺氧是一个关键特征,与恶性程度和不良预后相关。最著名的缺氧反应涉及转录调控的改变,但新证据表明缺氧会诱导缺氧诱导因子(HIF)之外的多种适应性信号。
转录因子ZHX2(zinc fingers and homeoboxes 2)是一个新近被发现的VHL底物,它可以通过HIF依赖和非依赖的方式激活癌基因,驱动肿瘤恶性进展。同时,生物大分子相分离能将蛋白质和核酸分隔成无膜细胞器,这一过程通常依赖于内在无序区(IDR)。相分离可以在转录活跃的区域重塑三维染色质组织,但在癌症中鉴定特异性的相分离仍是巨大挑战。ZHX2如何在缺氧条件下被调控,以及染色质结构对氧气敏感性的机制,目前尚不清楚。

论文索引
【DOI】10.1016/j.molcel.2025.03.009
【发表时间】2025年4月17日
【标题】Hypoxia-induced phase separation of ZHX2 alters chromatin looping to drive cancer metastasis
【单位/通讯作者】武汉大学 张敬
【关键词】ZHX2;相分离;缺氧;IDR;CTCF;染色质环;癌症转移
该研究揭示了一种由缺氧特异性诱导的ZHX2相分离机制。研究发现,转录因子ZHX2在缺氧反应下发生相分离,促进其在染色质上的占据,并激活一系列癌基因的转录。这些基因富集为转移相关基因,且不同于HIF的靶点,与乳腺癌的病理进展密切相关。机制上,缺氧通过一个富含脯氨酸的内在无序区诱导ZHX2相分离,这会增强ZHX2在S625和S628位点的磷酸化,进而将CTCF招募到转录凝聚体中,改变染色质环,最终驱动转移基因的转录和癌症转移。这些发现为理解癌基因激活提供了重要见解,并提示了一种基于相分离的癌症治疗策略。


向下滑动或点击放大查看所有内容
1、ZHX2在缺氧反应下形成核内凝聚体
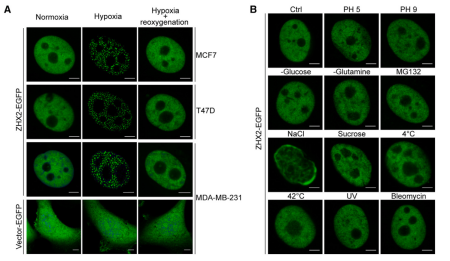
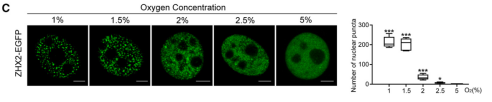
研究通过荧光成像技术,在多种乳腺癌细胞系(MCF7, T47D, MDA-MB-231)中观察到,ZHX2-EGFP在缺氧(1% O₂)条件下会形成明显的核内凝聚体,而在常氧(21% O₂)条件下则弥散分布。
这种凝聚体的形成是可逆的,在复氧后30秒内斑点即消失。ZHX2的聚集是缺氧特异性的,在其他细胞应激(如pH变化、葡萄糖/谷氨酰胺饥饿、MG132、UV照射等)下均未观察到斑点形成。
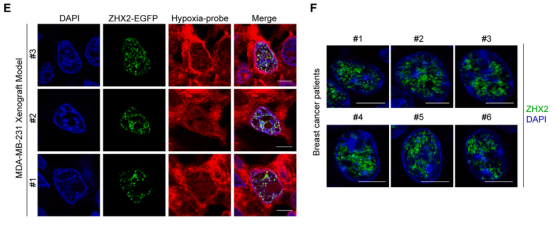
而在乳腺癌患者的肿瘤组织和异种移植肿瘤模型中也观察到了ZHX2核凝聚体。
2、富含脯氨酸的IDR介导ZHX2的缺氧诱导相分离

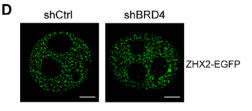
研究使用1,6-己二醇(1,6-hex)处理细胞,可阻断缺氧诱导的ZHX2凝聚体形成。
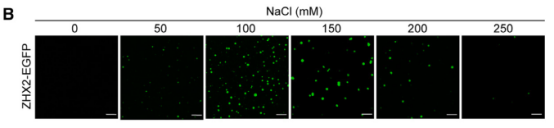
体外纯化的重组ZHX2-EGFP蛋白在特定浓度下也表现出盐敏感的球形斑点,证实了ZHX2凝聚体具有相分离特性。通过结构预测和OptoDroplet光遗传学技术分析,研究发现ZHX2的核定位序列(NLS;317-446 aa)区域内的IDR是驱动其相分离的主要区域;

删除NLS(ΔNLS)则无法在光照或缺氧下形成斑点(D-G)。

将该区域的7个脯氨酸全部突变为丙氨酸(PA突变体)后,ZHX2在缺氧条件下完全丧失了形成凝聚体的能力。这表明,该富含脯氨酸的IDR是ZHX2响应缺氧并诱导相分离的关键。
3、ZHX2相分离作为支架招募转录激活复合体
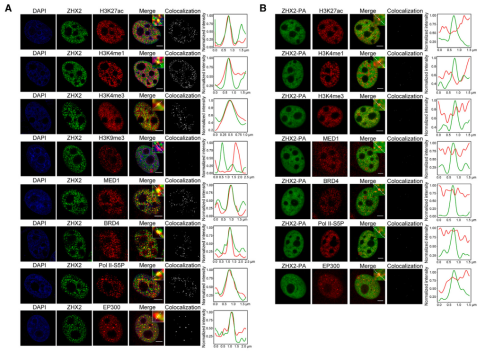
免疫荧光染色显示,缺氧诱导的ZHX2凝聚体与多种转录激活标记(H3K27ac, H3K4me1, H3K4me3, MED1, BRD4, RNA Pol II-S5P, p300)高度共定位。
Co-IP实验证实,与常氧相比,ZHX2在缺氧时与RNA Pol II-S5P, p300, BRD4, 和 MED1的相互作用显著增强。

而无法发生相分离的PA突变体,在缺氧时几乎不与这些共激活因子共定位,也几乎不发生相互作用。这些结果表明,ZHX2在缺氧时首先独立发生相分离,并作为“支架”招募这些转录共激活因子到凝聚体中。
4、ZHX2相分离激活一套不同于HIF靶点的转移基因特征集

ChIP-seq分析结果显示,在缺氧条件下,ZHX2在全基因组的占据位点数量和结合强度均显著增加,而PA突变体的基因组占据和结合强度与WT型相比则明显下降,表明ZHX2的相分离是其在缺氧时广泛结合染色质所必需的。


结合RNA-seq的结果综合分析,研究鉴定出125个“ZHX2 相分离基因”,它们在缺氧时以相分离依赖的方式被ZHX2直接结合并转录激活,且其激活独立于HIF1α/HIF2α(C, D, E)。
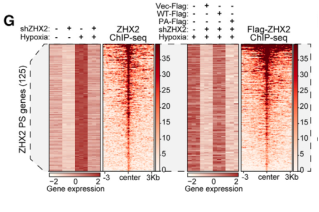
GO富集分析结果显示,这些基因高度富集在与癌症转移相关的通路。对乳腺癌患者的scRNA-seq数据分析证实,该转移特征集主要在恶性细胞中高表达。
5、ZHX2相分离通过招募CTCF重塑染色质环
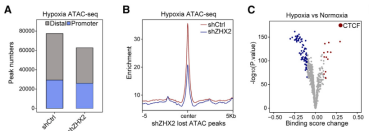
Co-IP和FRET-FLIM实验证明,缺氧诱导了ZHX2和CTCF之间的直接相互作用(A, B),而PA突变体则无法与CTCF结合。免疫荧光显示,CTCF本身在缺氧时也会形成核内斑点,并与ZHX2凝聚体高度共定位(C),表明ZHX2的IDR依赖性相分离将CTCF“拉入”了凝聚体中。
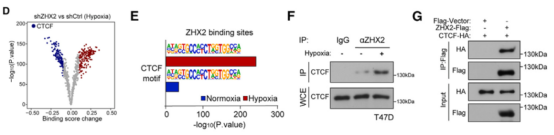
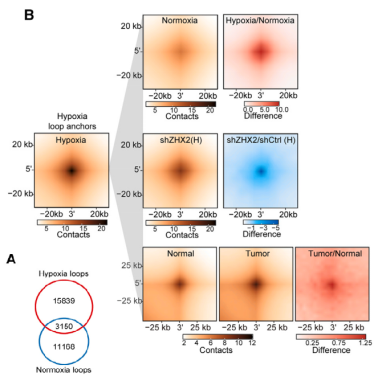
Hi-C实验进一步揭示,缺氧导致了全局性的染色质环重编程,产生了大量缺氧特异性的染色质环(D)。这种染色质环的重塑依赖于ZHX2(E)。3C-qPCR实验结果证实,ZHX2的PA突变体无法拯救由ZHX2敲低导致的MYC和STC2 E-P环的丢失(G)。
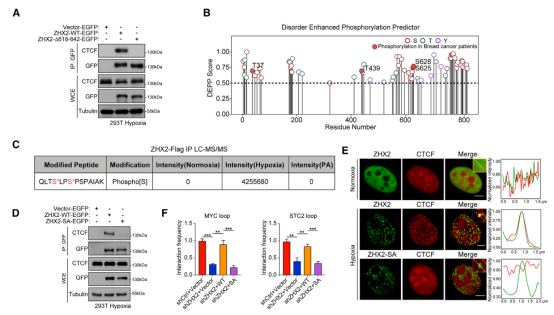
6、ZHX2相分离促进的S625/S628磷酸化是招募CTCF和驱动转移的关键
蛋白质谱(LC-MS/MS)分析鉴定出ZHX2的两个相分离增强的磷酸化位点:S625和S628。这两个位点仅在缺氧时,且在具有相分离能力的WT ZHX2上发生磷酸化,表明ZHX2相分离是其S625/S628位点磷酸化的先决条件。

将这两个位点突变为丙氨酸(SA突变体)后,ZHX2与CTCF的相互作用被完全阻断(D)。然而,SA突变体在缺氧时仍能正常发生相分离(形成斑点),但CTCF无法被招募到这些凝聚体中(E)。功能上,SA突变体无法恢复缺失ZHX2后导致的染色质环形成和靶基因(125个相分离基因)的下调(F)。
在细胞迁移、侵袭实验以及小鼠肺转移模型中,PA突变体(丧失PS)和SA突变体(丧失CTCF招募)均丧失了促进转移的能力(A-F)。

该研究提出了一个精细的调控模型:在缺氧条件下,ZHX2首先通过其富含脯氨酸的IDR发生相分离,形成核内凝聚体。这种相分离状态作为平台,一方面招募了MED1、BRD4和RNA Pol II等转录共激活因子;另一方面,它促进了ZHX2自身的S625和S628位点磷酸化。磷酸化的ZHX2进而获得了与CTCF结合的能力,将CTCF招募到凝聚体中。最终,ZHX2-CTCF轴在凝聚体内重塑了染色质高级结构,形成了新的增强子-启动子环(E-P looping),高效激活了包括MYC在内的一系列转移相关癌基因,驱动癌症进展。该机制揭示了染色质环如何动态响应氧气变化,并为靶向ZHX2-CTCF轴提供了新的癌症治疗思路。
- - - 推荐阅读 - - -
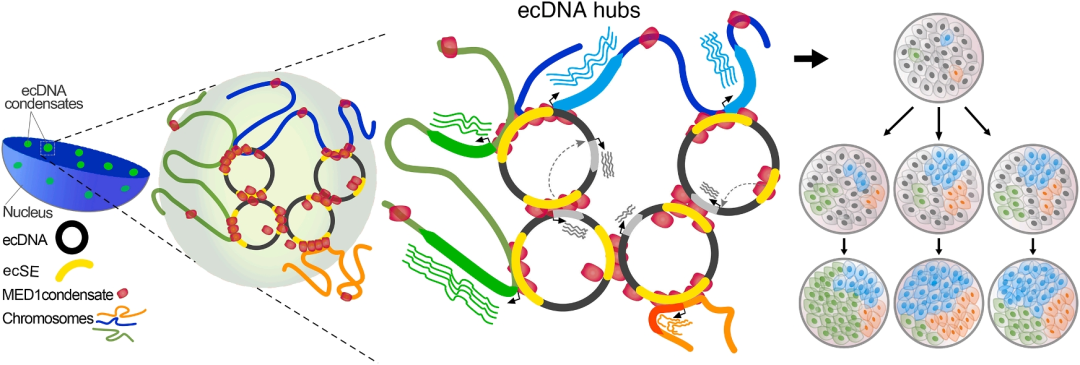
Cancer cell | ecDNA利用其超级增强子驱动相分离形成核内凝聚体,高效激活致癌转录
科学家们发现,ecDNA不仅仅通过增加癌基因拷贝数来促癌,它们还具有一种更隐秘的能力——充当"移动增强子"【6】。这些环状DNA携带的超级增强子区域,可以跨越染色体疆界,与远处的染色体基因建立联系,像遥控器一样远程激活这些基因的表达。
2025-10-24

Nature | 大脑如何变老?基因组-转录组变化洞察人脑衰老的演化
研究的核心结论是,健康大脑的衰老并非源于神经元功能身份的丧失,而是一场由基因“使用成本”驱动的、普遍性的细胞基础维护能力下降。
2025-10-11

Cell Genom | 如何利用三维基因组图谱和机器学习识别胰腺疾病的驱动增强子
这一系列结果证明,该研究建立的技术路线能够有效地将GWAS发现的抽象风险位点,转化为具体的细胞类型、功能元件和靶基因,为深入理解疾病的发病机制提供了关键线索。
2025-11-26
