Nature | 大脑如何变老?基因组-转录组变化洞察人脑衰老的演化
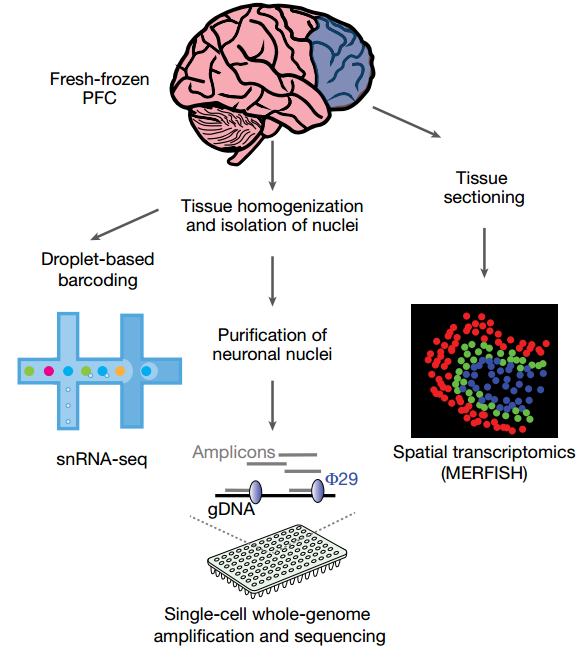
研究团队首先利用snRNA-seq技术,对19位年龄从4个月到104岁的人类前额叶皮层(PFC)样本进行了分析,共获得了超过36万个高质量的细胞核数据。通过降维聚类,他们鉴定出了31个不同的细胞亚群,包括各类兴奋性神经元、抑制性神经元、星形胶质细胞、少突胶质细胞、小胶质细胞等。
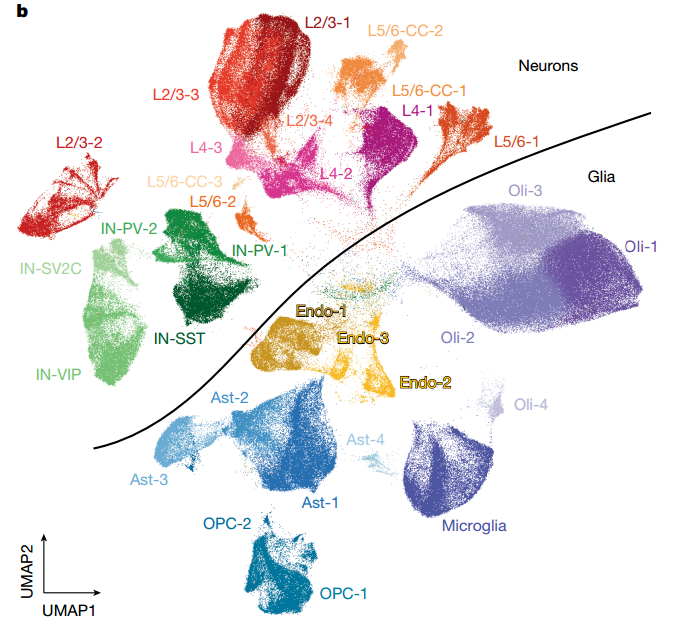
研究并未发现随着年龄增长,神经元与胶质细胞的整体比例或任何主要神经元亚型的数量发生显著变化,这表明在健康衰老过程中,大脑并未经历大规模的特定神经元丢失。此外,研究还识别出了仅在婴儿大脑中存在的特殊神经元和星形胶质细胞亚群,这些细胞高表达与神经发育和迁移相关的基因,证实了大脑在出生后仍在持续发育和成熟。

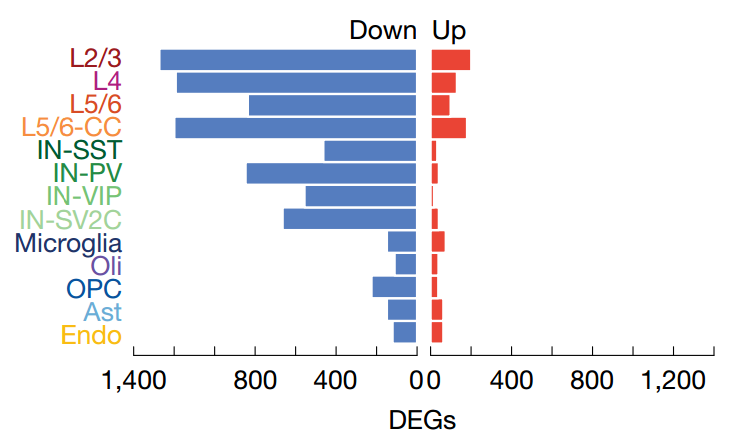
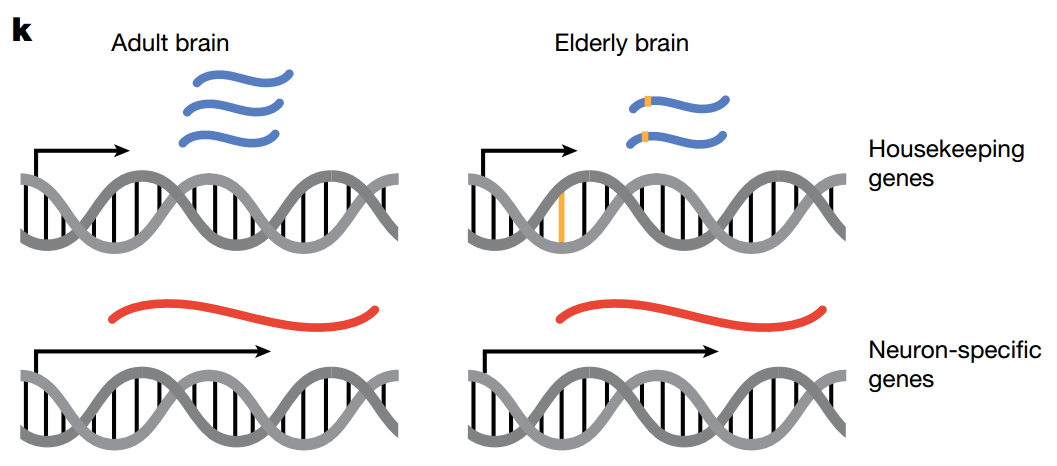
通过对不同年龄组的差异表达基因进行分析,研究揭示了一个贯穿多种细胞类型的核心衰老特征:大量负责维持细胞基本生命活动的“管家基因”(Housekeeping genes)的表达水平,在老年组(>65岁)中相较于成年组普遍下调。
基因功能富集(GO)分析结果显示,这些下调的基因主要集中在核糖体、翻译、新陈代谢和细胞内稳态等基础生物学过程(c)。利用DepMap数据库进行的分析进一步确认,这些表达下调的基因对细胞的生存至关重要(e)。
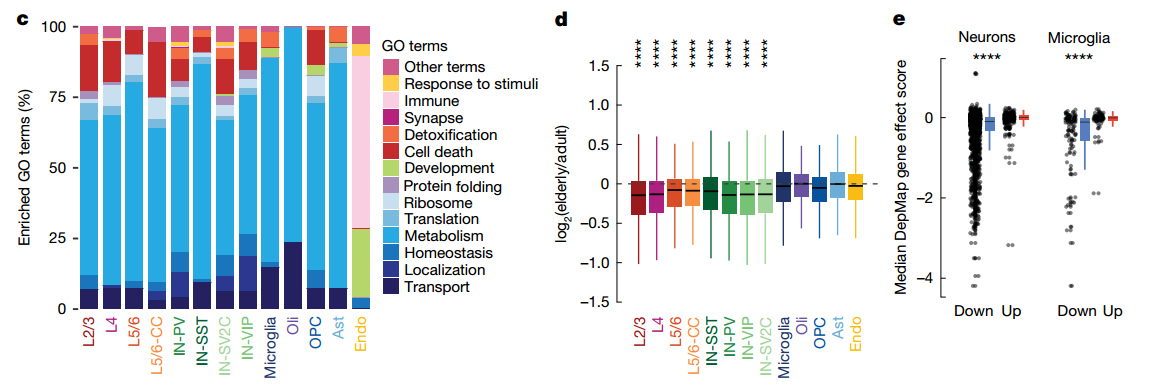
相反,那些定义神经元功能的特异性基因(Neuron-specific genes)的表达量在衰老过程中则基本保持稳定。为了验证这一关键发现,团队还运用了空间转录组学技术,在组织原位证实了核糖体蛋白和线粒体相关基因在老年大脑中的表达确实降低了。

为了探究转录变化背后的基因组根源,研究团队对来自相同供体的100个神经元进行了单细胞全基因组测序(scWGS)。他们发现,神经元中的体细胞单核苷酸变异(sSNV)会随年龄稳定累积。
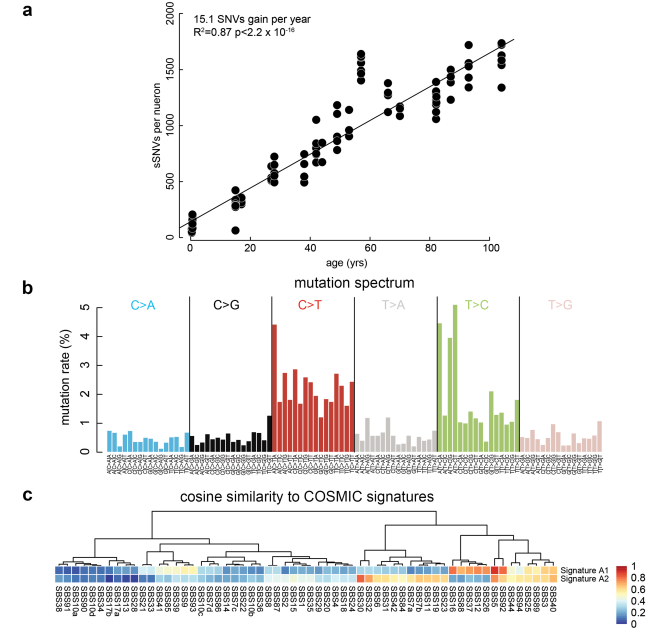
通过对这些突变进行从头(de novo)特征分析,他们识别出两种截然不同的突变印记(mutational signatures):A1和A2。其中,A1突变印记与供体年龄呈现极强的正相关,并且其突变丰度在转录活跃(高表达)的基因中显著富集。
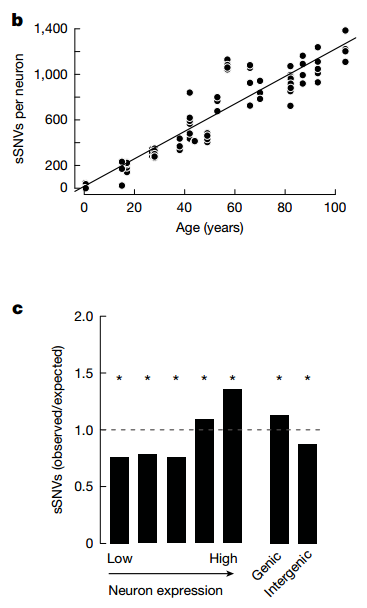
这种转录关联的突变模式,暗示了基因的表达过程本身可能就是一种诱发DNA损伤的风险因素。相比之下,A2突变印记则主要富集在转录不活跃的区域,可能更多地反映了发育早期的突变事件。
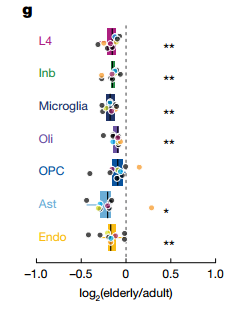
最后,研究团队整合了转录组和基因组数据,构建了一个多元线性回归模型,旨在揭示影响衰老过程中基因表达变化的决定性因素。模型分析得出了一个核心结论:基因的表达水平与其在衰老过程中的表达下调呈负相关,而基因的长度则与其表达稳定性呈正相关。
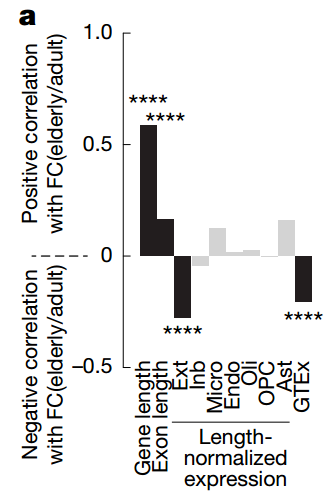
这意味着,那些短小且高表达的“管家基因”最容易在衰老中表达下调,而那些长链的“身份基因”则倾向于维持表达。这一模型完美地解释了前述的观察结果。进一步分析显示,在“管家基因”中,其sSNV突变率与基因长度呈负相关,即最短的管家基因突变率最高。

综合来看,研究提出了一个精炼的衰老机制模型:高频的转录活动使得短小的管家基因持续暴露于DNA损伤风险之下,累积的突变最终导致其功能性转录本减少,从而引发普遍的细胞维护能力下降。
综上,该研究通过整合单细胞多组学数据,为人类大脑的衰老过程建立了一个全新的分子模型。研究的核心结论是,健康大脑的衰老并非源于神经元功能身份的丧失,而是一场由基因“使用成本”驱动的、普遍性的细胞基础维护能力下降。具体而言,那些维持细胞生存所必需的、短小且高表达的“管家基因”,因其持续的转录活性而更容易累积DNA损伤,最终导致其表达下调和功能衰退。这一机制不仅深刻重塑了我们对正常衰老的理解,将衰老的根源指向了生命活动中最基础的转录过程本身,也为阿尔茨海-默病等年龄相关神经退行性疾病的发生提供了“土壤”假说:一个本已处于维护不善的脆弱状态下的细胞系统,可能更容易在其他病理压力下崩溃。未来的研究方向应聚焦于增强DNA损伤修复、保护高表达基因稳定性的策略,这可能为延缓大脑衰老和防治相关疾病开辟全新的干预途径。
- - - 推荐阅读 - - -

Science | 靶基因如何限制其增强子的作用范围?基因调控新发现
基因调控新发现
2025-09-26

创新组合测序方法揭示转录因子特殊调控机制
转录因子是哺乳动物细胞中一类重要的基因调控元件,很多疾病的发生都与转录因子功能失调有关。2015年,美国麻省总医院及哈佛医学院研究者联合在Science发文,公布了他们关于转录因子与基因调控元件中DNA及RNA之间
2020-06-23
新型ChIP-Seq技术实现超低细胞数量组蛋白修饰精确检测
在2016年9月发布的Nature中,同济大学高绍荣教授研究组通过对组蛋白修饰技术ChIP-Seq加以改进,第一次系统检测了小鼠植入前胚胎发育各个时期全基因组范围内H3K4me3和H3K27me3两种重要组蛋白修饰分布与变化。
2018-03-05