新品促销 | DRUG-seq建库试剂盒,赠送测序与数据分析服务

DRUG-seq建库试剂盒
赠送测序与数据分析服务
Epi™ DRUG-seq Library Prep Kit是一款用于快速转录组测序的建库试剂盒,针对微量细胞或组织样本,低细胞起始量(1,000~10,000)即可实验;无损直检,裂解液直接上样,避免RNA提取损耗;无需自备磁珠,通过独特的分子标签,高效且灵敏捕获mRNA,可实现多样本混合建库,每个UMI可对捕获的mRNA进行精确定量,以降低PCR扩增带来的数据遍差。凭借低样本量低成本高效批量化检测的优势,广泛应用于药物筛选、肿瘤溯源、类器官等研究领域。

试剂盒信息
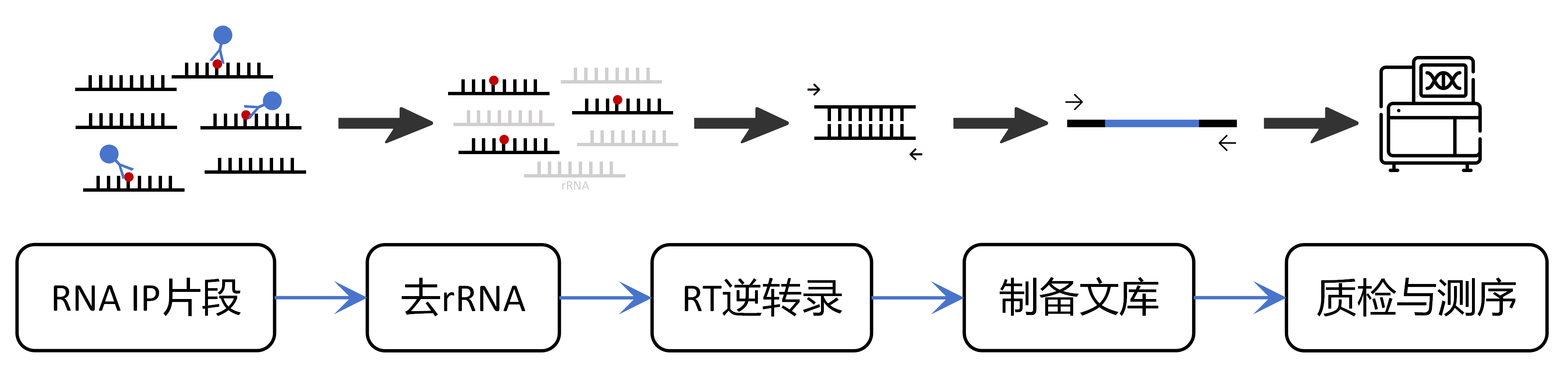
实验流程
产品亮点
1. 低样本起始量,1,000~10,000个细胞均可实验,适用多细胞类型或类器官等
2. 独特的barcode+UMI可实现多样本合并建库和精准定量,可批量化测序,成本远低于常规RNA-seq
3. 细胞样本无需提取RNA,直接裂解后建库,简化流程并减少批次差异
技术应用
1. 药物筛选与开发(靶点识别、化合物评估等)
2. 肿瘤等疾病机制研究(肿瘤溯源、生物标志物发现等)
3. 干细胞与类器官研究
4. 基因功能研究
测序送样要求
1. 混合样品数:5~8个
2. 文库片段:600~800 bp
3. 浓度和体积:浓度≥10 ng/μL,体积>20 μL
4. 推荐测序数据:10 M/子文库(如5个样品混合则50 M/文库)
分析内容
1. 数据质控
2. 基因比对与统计
3. 差异表达分析
4. 基因功能GO分析
5. 代谢通路KEGG分析
6. 差异基因热图分析
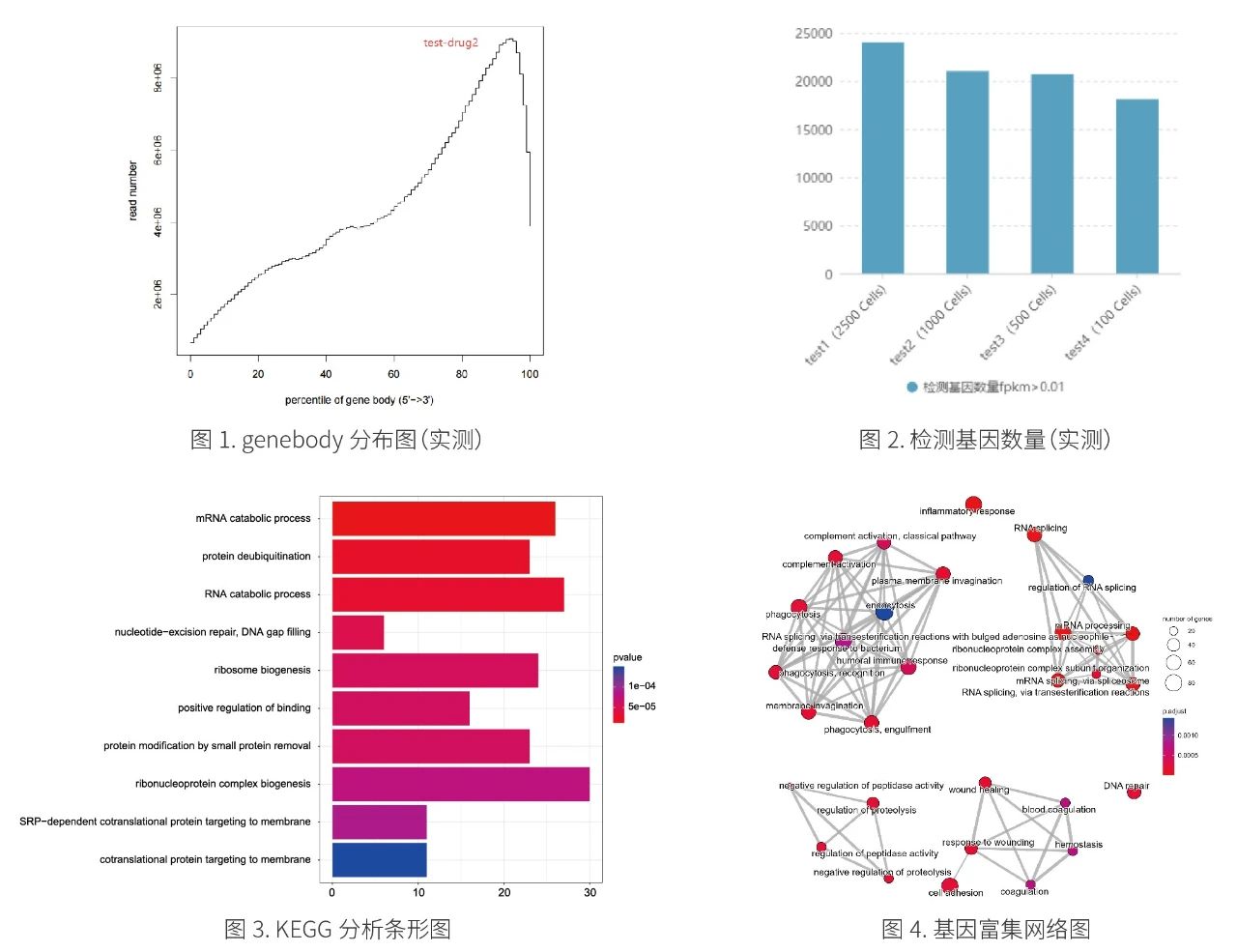
数据分析示例
研究案例
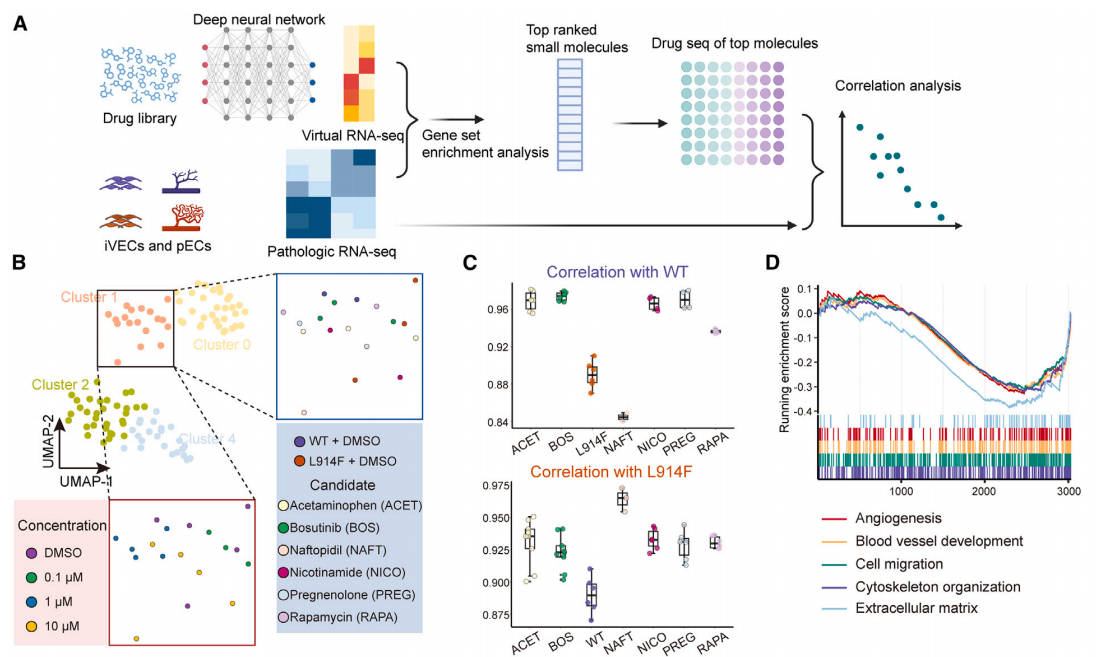
1.Cell Stem Cell:利用iPSC衍生的静脉内皮细胞建模血管畸形及药物发现(DOI: 10.1016/j.stem.2024.10.015)
这篇文章利用iPSC分化、CRISPR-Cas9、体外功能测定、体内肾包膜移植和DRUG-seq等方法,生成了携带TIE2基因突变的人类静脉内皮细胞(iVEC),构建了能模拟人类静脉畸形(VM)的体外和体内模型,并通过AI辅助的DRUG-seq筛选发现Bosutinib是潜在的治疗药物。研究中利用DRUG-seq结合深度学习模型(DLEPS),对携带TIE2突变的iVEC进行了高通量药物筛选,通过分析候选药物处理后细胞的转录组变化,识别能够逆转VM表型、使突变细胞转录组更接近野生型细胞的潜力药物。
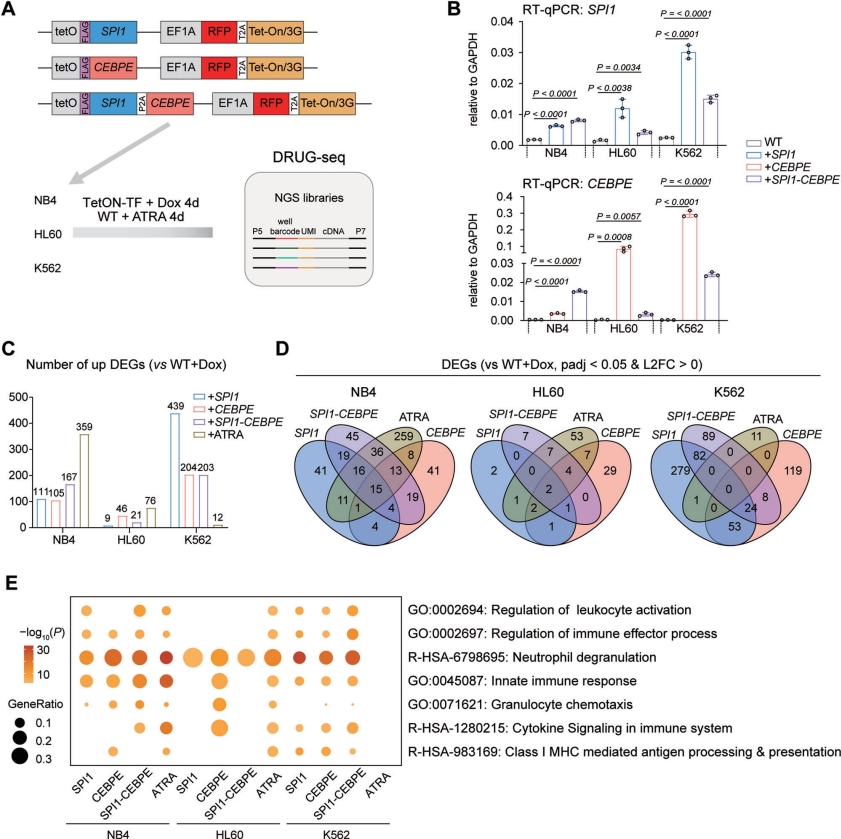
2.Oncogene:结核分枝杆菌通过EsxB抑制METTL14介导的Nox2 mRNA m6A甲基化以削弱抗结核免疫(DOI: 10.1038/s41388-025-03309-z)
这项研究通过整合单细胞ATAC-seq和单细胞RNA-seq,结合CRISPRi、ATAC-seq及DRUG-seq等技术,探究了全反式维甲酸(ATRA)诱导PML/RARα+急性早幼粒细胞白血病(APL)细胞系NB4分化的调控机制。研究发现ATRA通过激活PML/RARα靶向增强子,触发SPI1和CEBPE转录因子形成的正向调控环路,驱动NB4细胞跨越命运决策点完成终末粒细胞分化,并在非APL白血病细胞(HL60、K562)中验证了该环路的普适性分化诱导作用。其中DRUG-seq用于高通量分析SPI1和/或CEBPE过表达在NB4、HL60和K562细胞中的转录组效应,揭示了这些转录因子单独或协同激活粒细胞相关基因(如中性粒细胞脱颗粒通路),证实其在缺乏ATRA时仍能诱导部分分化程序。
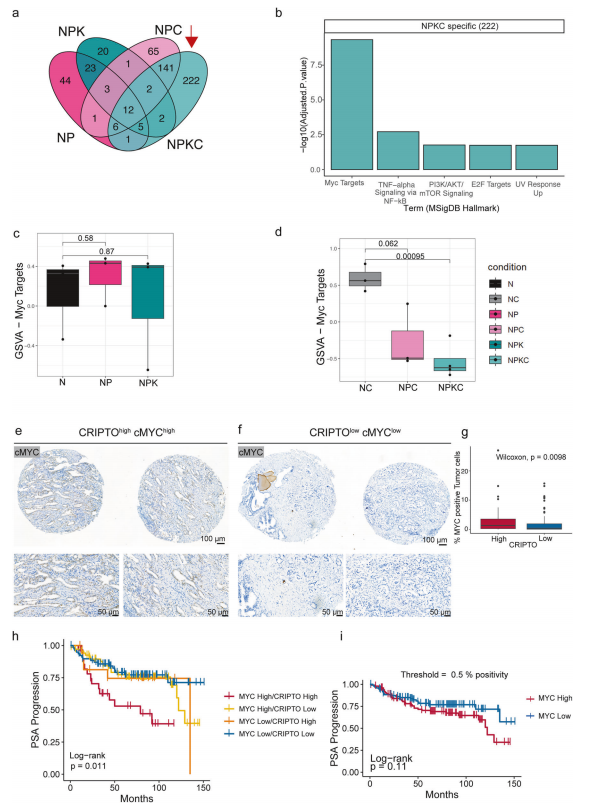
3.Oncogene:基于体内、类器官和患者数据的揭示CRIPTO在驱动侵袭性前列腺癌中的多层面作用(DOI: 10.1038/s41388-024-03230-x)
这项研究通过结合小鼠模型、类器官培养和患者数据,深入探讨了CRIPTO在前列腺癌发生和进展中的作用。研究人员构建了在前列腺特异性表达可诱导型Cre酶,并在CARNs(castration-resistant Nkx3.1-expressing cells,前列腺癌中发生癌变的靶细胞群)中敲除Cripto的转基因小鼠模型 。通过对不同基因型小鼠进行去势和睾酮再给药处理,模拟前列腺癌的进展过程。研究还分析了欧洲多中心高危前列腺癌临床和转化研究组(EMPACT)患者队列的组织芯片(TMA)数据,评估CRIPTO表达与临床及PSA进展的相关性。其中利用BRB-seq(DRUG-seq)对小鼠前列腺组织和类器官的转录组进行了测序和分析,重点分析了差异表达基因的功能富集,特别是MYC靶基因的变化。研究结果发现CRIPTO 驱动侵袭性前列腺癌的发生和进展,且与MYC协同作用,提示CRIPTO是潜在的治疗靶点和生物标志物。
