Epi™ Gapmer ASO设计及合成服务

项目简介
Epi™ Gapmer ASO是一类能高效抑制RNA分子功能的特殊修饰反义核酸,可用于各种RNA的功能分析,在体内和体外进行功能缺失性实验。表观生物提供Gapmer ASO设计及合成服务,通过创新的化学修饰技术与精准的序列设计,实现对目标RNA的高效、特异性降解,为您的功能缺失性研究提供体内外双重解决方案,同时也是类器官功能研究的利器。
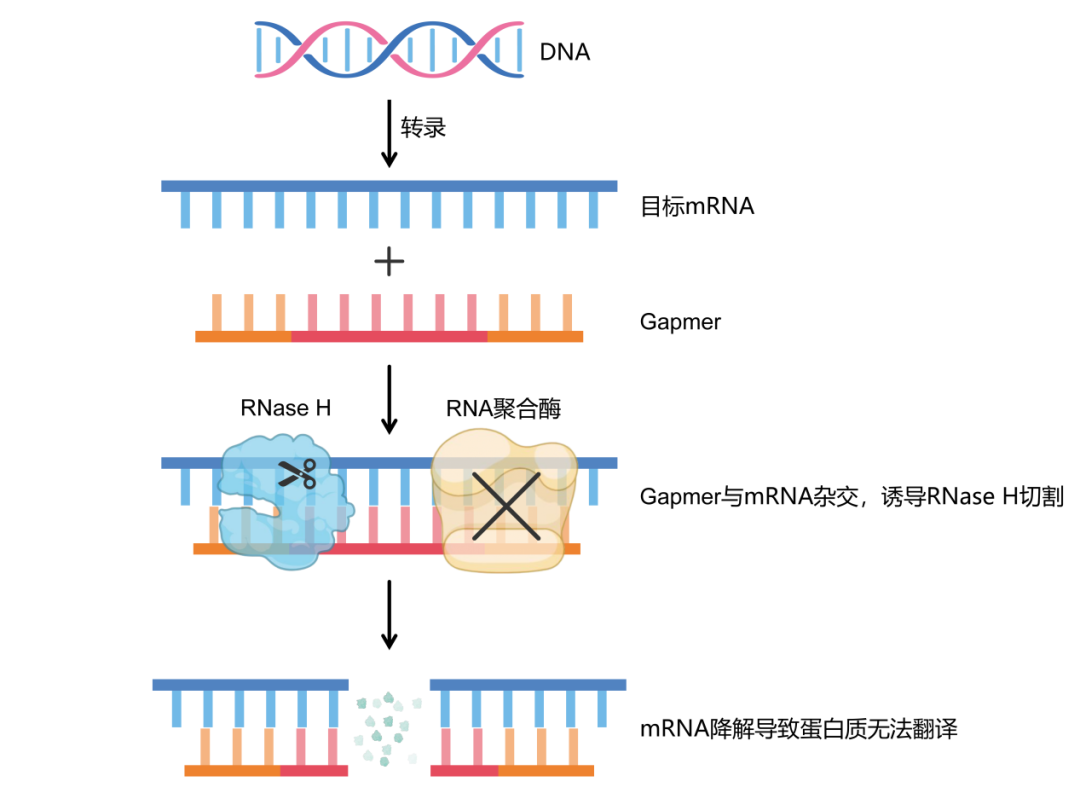
产品信息
Gapmer ASO基于锁核酸(Locked nucleic acids,LNA)修饰的反义寡核苷酸(anti-sense oligo nucleotide,ASO)。ASO主要是通过碱基互补配对与靶标mRNA、ncRNA结合,导致RNase H剪切靶标mRNA、ncRNA,从而抑制基因表达;也有ASO通过抑制Ribosome翻译蛋白、调节RNA剪接等机制发挥作用。而LNA修饰的ASO在与互补的RNA链杂交仍具有热稳定性,具有完全修饰的磷酸硫酯骨架,确保了对酶解的高抗性能力,能够催化RNase H依赖性的互补RNA靶标的降解,从而确定丧失的靶标功能。
技术优势
1.高效降解目标RNA,特别是细胞核内的 eRNA 分子
2.锁核酸修饰带来高结合力,优异的沉默效能;体内实验所需剂量低,作用时间长
3.无需转染试剂,适用于难转染的细胞、类器官
4.免费提供序列设计
应用场景
1.功能机制研究:各类RNA分子的分子功能验证及作用网络研究
2.疾病模型构建:肿瘤、神经疾病、代谢性疾病中非编码RNA的致病机制探究
3.动物体内实验:全身/局部给药的基因沉默效果评估
4.类器官实验:沉默靶基因,解析非编码RNA对疾病的调控机制
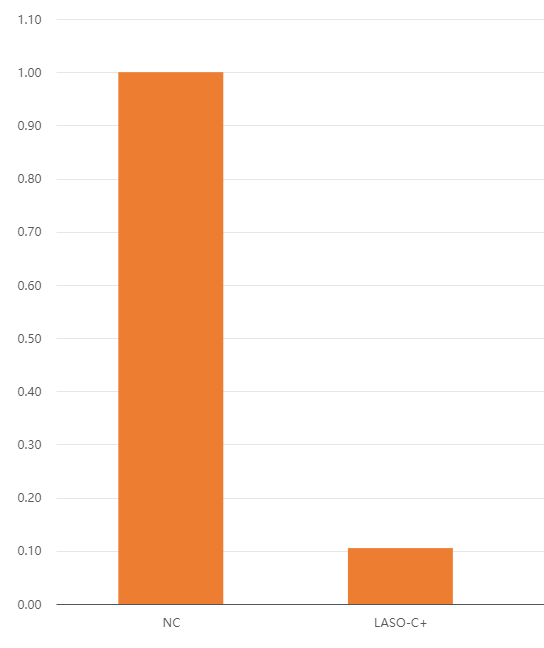
图1. Gapmer ASO在细胞系中的沉默效果(左为阴性对照,右为实验组)
实测数据
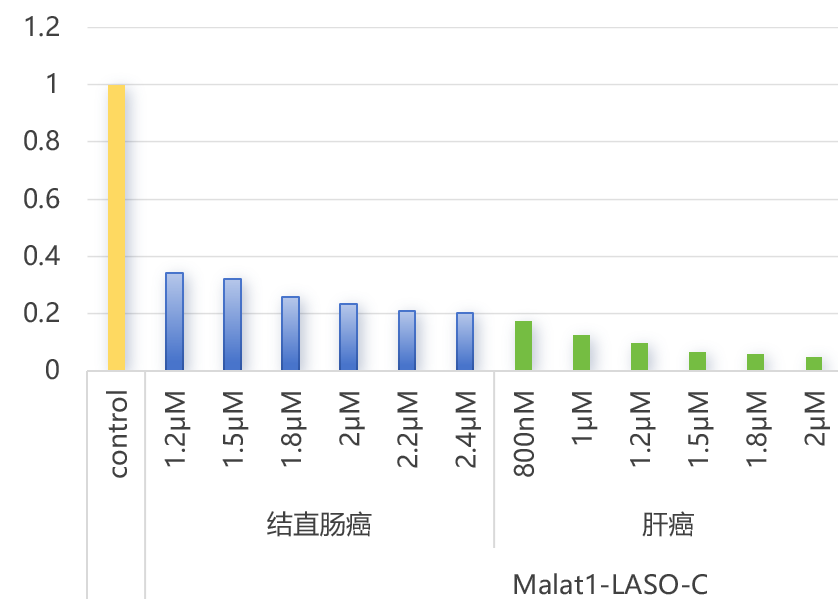
图2. Gapmer ASO在多种肿瘤类器官中的沉默效果
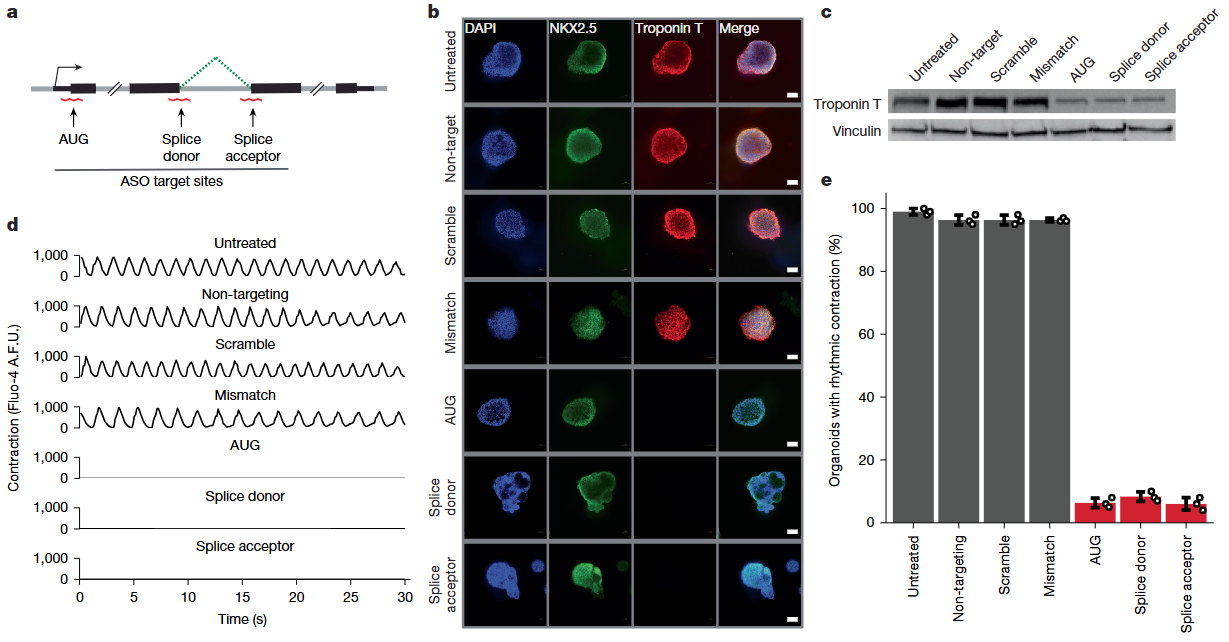
图3. ASO在心脏类器官中实现强效基因扰动的完整验证过程
应用案例
1.Nature:基于患者来源类器官的快速个性化ASO药物筛选平台(DOI: 10.1038/s41586-024-08462-1)
这项研究建立了基于患者来源类器官的ASO药物评估平台。研究团队从患者血液快速生成iPSC并分化为心脏类器官,成功在类器官中验证了ASO的治疗效果。通过转染ASO到DMD患者的心脏类器官中,ASO能够有效调节RNA剪接、恢复肌营养不良蛋白表达,并改善类器官的收缩功能。该平台实现了从患者样本到ASO效果评估的全流程自动化,为个性化ASO药物开发提供了快速、可靠的体外评估模型。
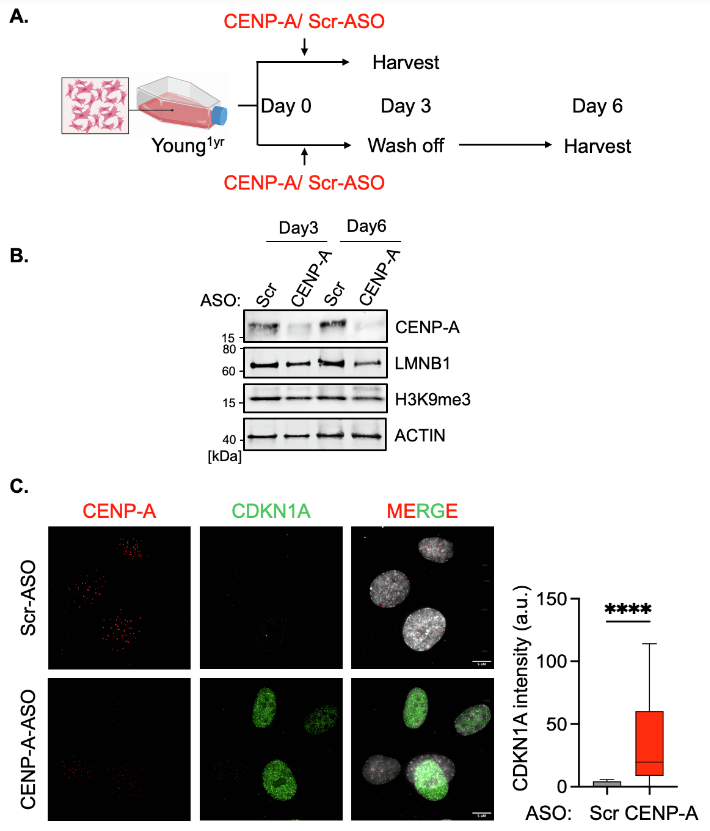
图4. 研究者使用ASO特异性靶向敲低皮肤成纤维细胞中的CENP-A,结果显示CENP-A的敲低显著增加了衰老标记物CDKN1A/p21的表达,同时导致lamin B-1的降解
2. Mol Cell:衰老过程中着丝粒失活及其在人类细胞中的挽救机制(DOI: 10.1016/j.molcel.2024.12.018)
文章中使用Gapmer ASO进行了CENP-A和CENP-B的敲低实验,从而研究这些蛋白在衰老过程中的作用。
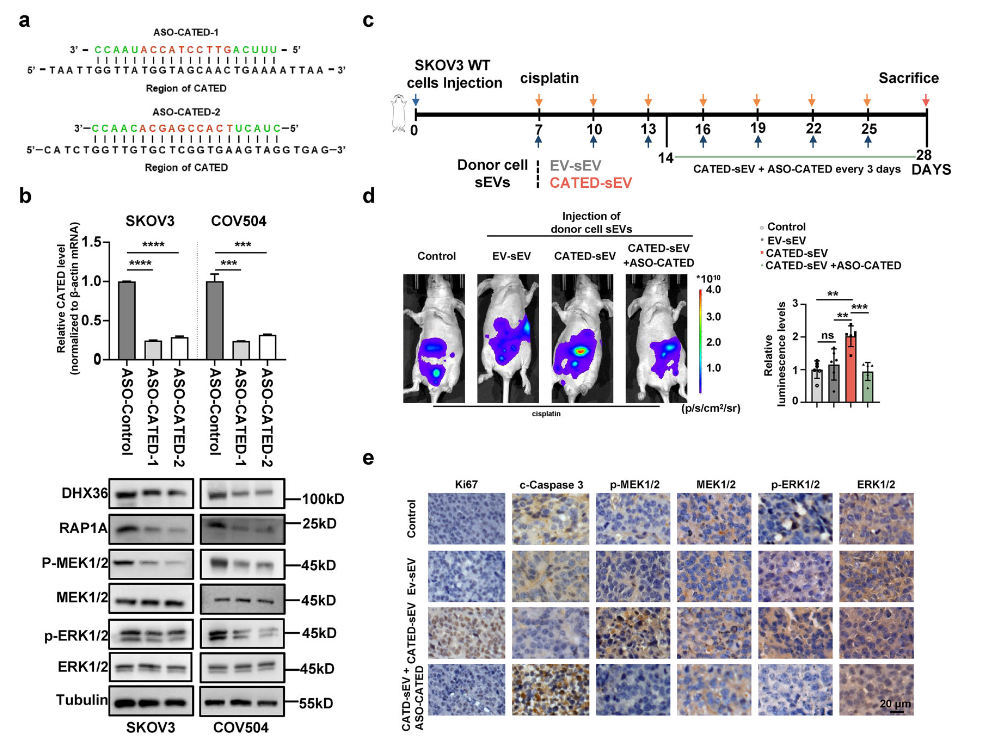
图5. 两种针对CATED不同区域设计的Gapmer ASO序列,中间的DNA序列用红色标记;RT-qPCR和WB结果显示ASO成功降低了CATED表达,同时降低了DHX36和RAP1A蛋白水平,抑制了MAPK-ERK通路激活
3. Adv Sci:长链非编码RNA CATED促进高级别浆液性卵巢癌铂类耐药及其靶向治疗策略(DOI: 10.1002/advs.202505963)
这项研究揭示了一种新型长链非编码RNA CATED在高级别浆液性卵巢癌(HGSOC)铂类耐药中的关键作用。研究发现CATED可通过肿瘤来源的小细胞外囊泡(sEVs)传递,促进HGSOC细胞对顺铂的耐药性。
机制上,CATED与RNA解旋酶DHX36结合,通过促进PIAS1介导的DHX36 SUMOylation修饰增强其稳定性,进而促进RAP1A的翻译,最终激活MAPK信号通路,导致细胞增殖增加和凋亡抑制。研究者开发了针对CATED的ASO治疗策略,成功逆转了HGSOC的铂类耐药性。
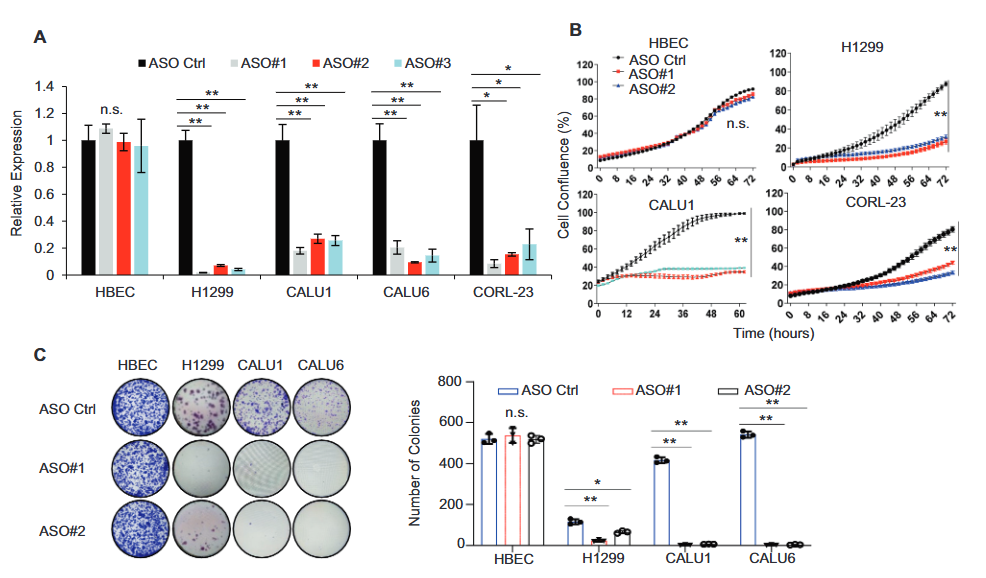
图6. ASO沉默HIF1A-As2显著抑制多种NSCLC细胞系的生长和集落形成
4. Cell Death Differ:HIF1A-As2与MYC形成正反馈环促进KRAS驱动的非小细胞肺癌增殖和转移(DOI: 10.1038/s41418-023-01160-x)
该研究发现长非编码RNA HIF1A-As2在非小细胞肺癌(NSCLC)中高表达,并与KRAS信号通路密切相关。文章中gapmer ASO用于沉默HIF1A-As2。
