这篇 Cell 文章告诉你如何研究外泌体 miRNA
研究外泌体miRNA的文章越来越多,可是高分的并不多。怎么样的外泌体实验结果在审稿人眼中才具有说服力?Epi老师今天带你们看看这篇最近发表于Cell的外泌体miRNA文章。
肥胖引起的慢性组织炎症是胰岛素抵抗和2型糖尿病的根本原因。加州大学的研究者发现外泌体介导的细胞间通讯导致了糖尿病中的代谢紊乱,外泌体携带的miRNA参与了糖尿病产生的关键机制。
1. 鉴定外泌体
研究者从肥胖小鼠的内脏脂肪组织中分离脂肪组织巨噬细胞ATM,通过超速离心提取外泌体,电镜和NTA分析;并进一步经过密度梯度离心纯化外泌体,鉴定蛋白标志物。
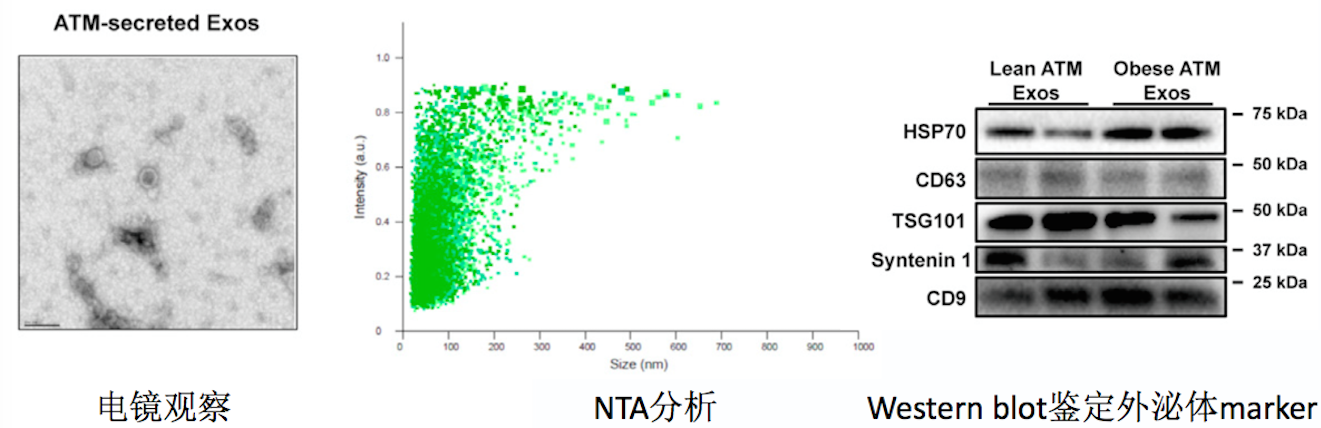
电镜观察外泌体典型杯状囊膜结构,NTA分析外泌体的粒径和浓度表征;Western blot鉴定有TSG101等外泌体蛋白标志物。
通过这三个实验,研究者证明ATM细胞确实会分泌外泌体,且已被研究者成功富集。
Transwell小室实验
研究外泌体功能,Transwell小室实验往往是不可缺少的一步,用于证明外泌体从供体细胞释放后,能到达受体细胞,且外泌体以及它体内的货物cargo均能被受体细胞吸收。
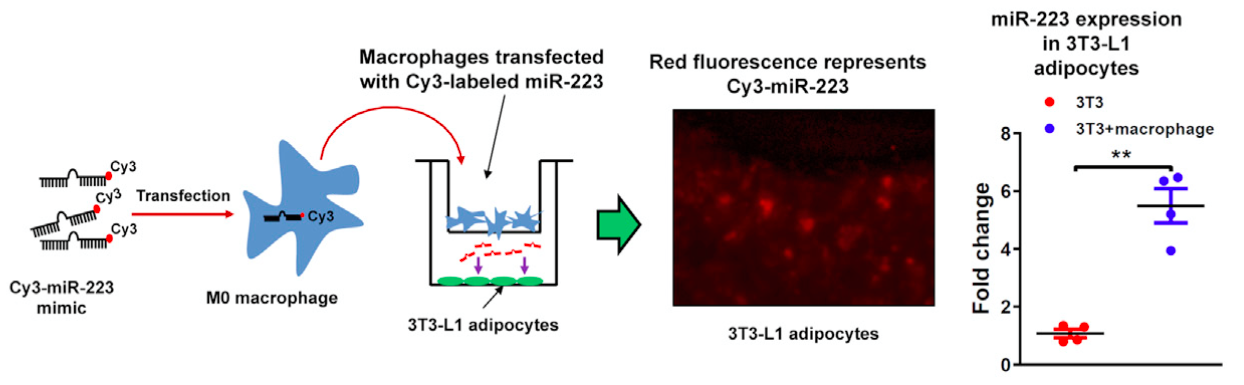
将Cy3标记miR-233 mimic的转染进初始巨噬细胞,然后培养于Transwell的上室,下室是不表达Cy3标签的3T3-L1脂肪细胞。共培养12h后,在下室中观察得红色荧光的Cy3-miR-233,是共培养前的6倍,表明这两种细胞间存在一种介质起了运输miRNA的作用。
外泌体跟踪
Transwell小室实验仅能证明上下两室的两种细胞之间确实发生了物质运输传递,但就此说是外泌体发挥的作用的话,还言之过早。我们可以给外泌体加上可视的标记,“看看”外泌体是否进行了细胞间转运。
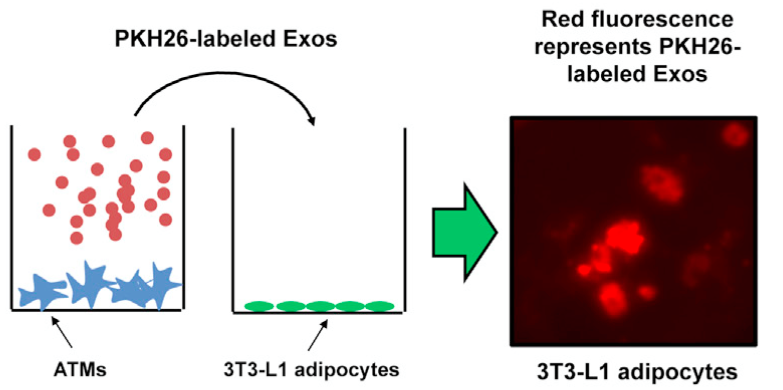
从ATM细胞提取外泌体,加上PKH26标签,添加到3T3-L1脂肪细胞培养基中,12h后,在细胞里面观察得到红色的带PKH26标签的外泌体。
外泌体分泌阻断
利用抑制胞外囊泡的药物,使细胞减少外泌体的分泌,再来检测“货物”的表达水平结果,可为外泌体运输物质提供强有力的证据。
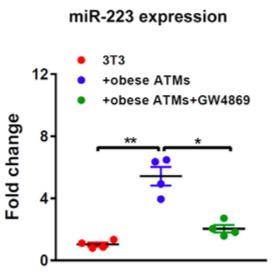
使用GW4689抑制外泌体释放之后,miR-233减少,表明是外泌体从ATM细胞转运miRNA到受体细胞。
已经证实ATM细胞分泌的外泌体能够转运miRNA到3T3-L1脂肪细胞,接下来可以把外泌体添加到细胞培养基或静脉注射到动物模型,观察表型。
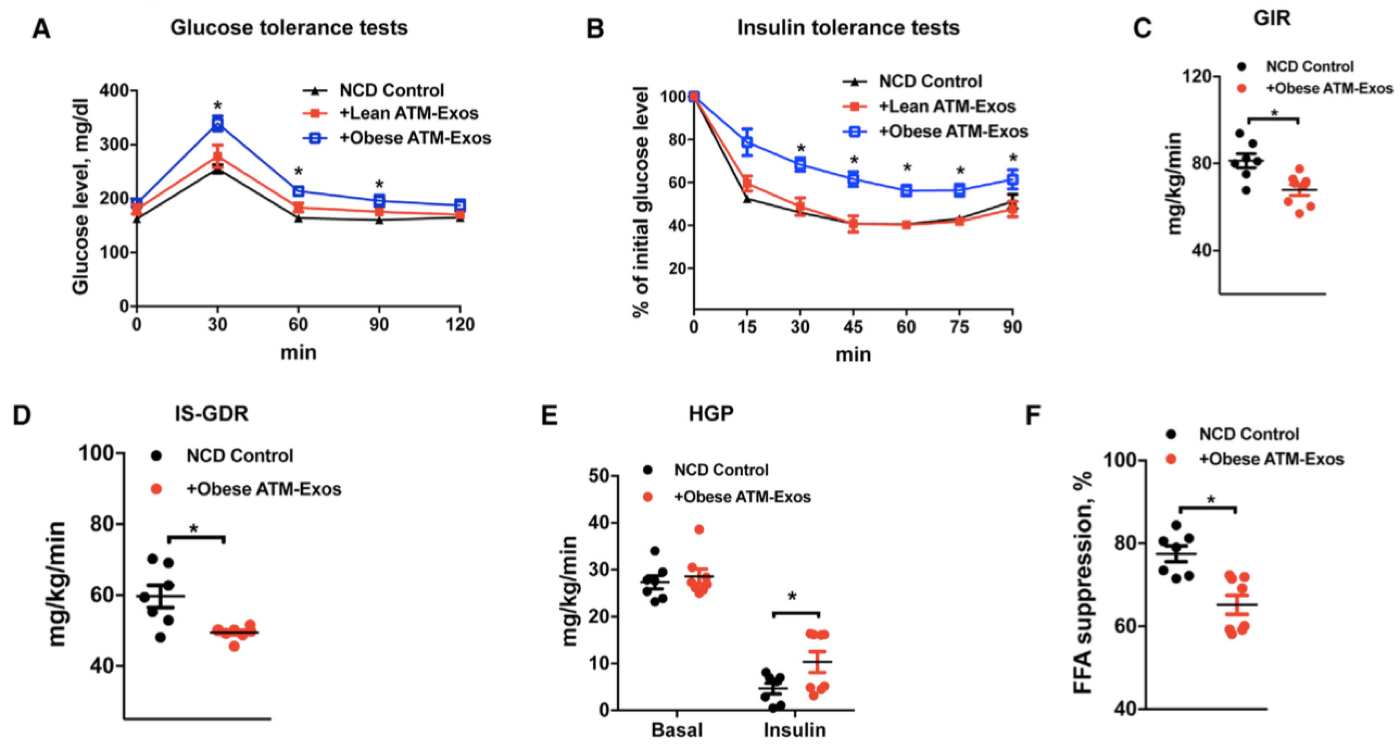
从肥胖小鼠ATM中提取外泌体,静脉注射到正常小鼠中,2周后,发现小鼠的葡萄糖耐受能力、胰岛素敏感性、葡萄糖输注率(GIR)、胰岛素刺激的葡萄糖代谢速率(IS-GDR)、肝脏糖产出量(HGP)和循环系统中的游离脂肪酸(FFA)都下降了,而瘦的小鼠来源的ATM-exo没有产生影响。表明肥胖动物的ATM细胞产生含miRNA的外泌体,在体内减弱胰岛素敏感性。
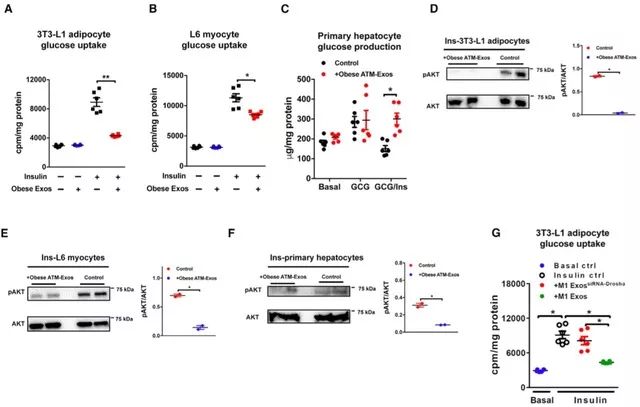
将上述外泌体添加到多种细胞株的培养基中,24h后可观察得细胞胰岛素敏感性下降,与动物实验结果一致。
4. 外泌体miRNA测序
已知是外泌体中的miRNA发挥了显著的作用,可到底是哪些miRNA呢?这时候,就可以通过高通量测序寻找其中起着关键作用的分子。
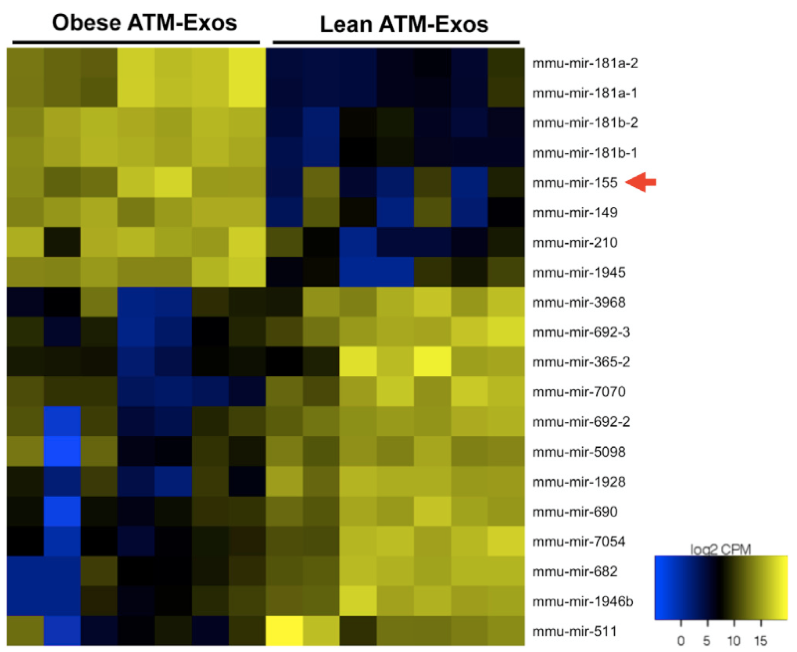
测序样本:瘦的ATM-exo VS 肥胖ATM-exo。测序获得的差异表达miRNA中,miR-155曾被报道通过抑制PPARγ,影响脂肪细胞分化,于是研究者选择了miR-155继续研究。
确定研究目标后,下一步就可以开展该目标miRNA的功能研究。
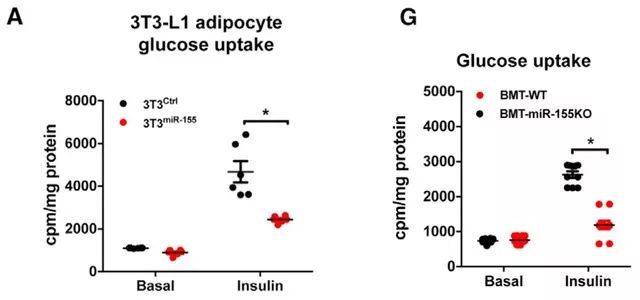
这项研究发现了脂肪组织中的巨噬细胞会利用外泌体调节全身的胰岛素应答。而其他组织例如β细胞、干细胞或肌细胞等是否有相似的代谢作用,还有待我们探索。文章里进行的实验都是经典且具说服力的外泌体研究实验,颇具学习参考价值。
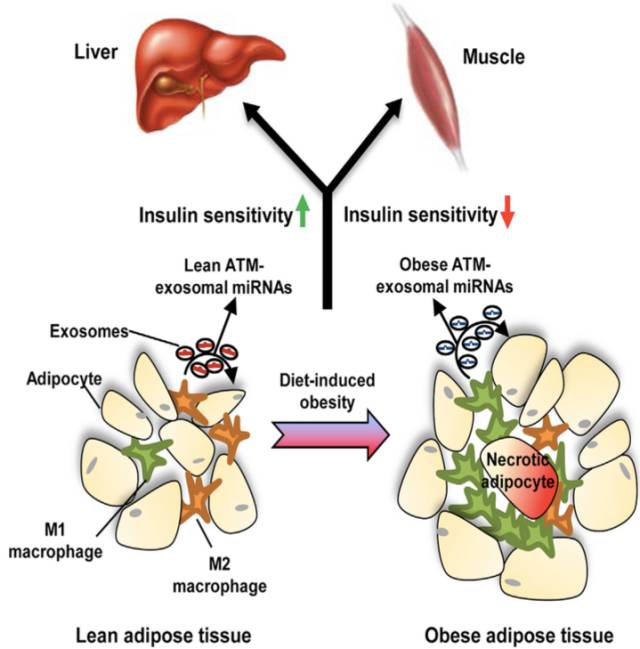
这项研究发现ATM-Exo miRNA存在于旁分泌和内分泌信号通路系统,在这些信号通路中,促免疫和抗炎症ATM可影响远端组织的代谢事件。
原文: Ying et al., Adipose Tissue Macrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro In- sulin Sensitivity, Cell (2017),
- - - 推荐阅读 - - -

Mol Cell: Spt6利用超级增强子维持细胞多能性
延长因子Spt6如何利用超级增强子、多梳蛋白使ESC细胞保有多能性?10月19日,Mol Cell上发表的一篇来自NIH研究者的文章解答了这个问题。
2017-10-30

RNA表观遗传学开创者何川: 总想着赚钱太急功近利
何川,RNA表观遗传学开创者。早年毕业于中国科技大学,2000年获麻省理工学院博士学位,2000到2002年在哈佛大学做博士后研究,2002年至今执教芝加哥大学化学系, 是芝加哥大学生物物理动态研究所主任, 北京大学合成与功能生物分子中心主任. 何川,RNA表观遗传学开创者。早年毕业于中国科技大学,2000年获麻省理工学院博士学位,2000到2002年在哈佛大学做博士后研究,2002年至今执教芝加哥大学化学系,是芝加哥大学生物物理动态研究所主任,
2017-10-10

分子刹车片假说:组蛋白修饰如何影响基因表达
今天我们来谈谈组蛋白修饰的过去与未来:从研究技术,到HAT/HDAC的分子刹车片假说。
2017-09-25
