分子刹车片假说:组蛋白修饰如何影响基因表达
所有生物体的基因组都想方设法地完成一件有趣而复杂的事——那就是如何将自己打包进小许多个数量级的空间里。比如人的体细胞基因组差不多有两米长,但它必须被压缩进直径只有10uM的细胞核。
如何完成如此高难度的压缩?实现这一点,需要将染色质组织成蛋白质—DNA复合物。组蛋白是这些复合物的重要组成部分,它们的翻译后修饰给这种结构和调控平台带来了许多功能。美国斯克利普斯研究所的整合结构和计算生物学教授Peter E. Wright说:“组蛋白有很多固有无序 (intrinsic disorder),是暗蛋白质组的一部分。”蛋白质组学面临着很大的挑战,就是因为大约三分之一的蛋白质组是由固有无序蛋白和无序蛋白质区域组成的,有的是完全无序的蛋白质,大部分的是既含有有序又有无序区域的蛋白质。
我们可以用传统的技术如X-射线晶体学来检测这些蛋白的球状结构域,用核磁共振光谱检查无序域。但是Wright博士认为,我们需要从整体上来研究,而不是使用现在的简化方法 (current reductionist approach)。
目前研究无序蛋白的方法有电子显微镜、质谱、单分子荧光共振能量转移 (smFRET) 和小角X射线散射。Wright博士说,希望很快看见一种新的技术来解决整个问题,但目前我们需要协同所有这些不同的技术来研究复杂无序的蛋白质是如何发挥作用的。
组蛋白影响基因表达—分子刹车片假说
组蛋白的无序区往往伴随着翻译后修饰。研究证明,磷酸化和乙酰化主要发生在无序区。Wright博士研究团队最近完成了对CREB (即环磷腺苷效应元件结合蛋白) 的结合蛋白 (CBP) 催化核心的晶体结构的研究。
CBP包含一个球状催化亚基和一个大约70个氨基酸无序区,起着调节作用。Wright博士的研究表明,一些赖氨酸残基在组蛋白乙酰转移酶 (HAT) 的自调控环 (autoregulatory loop)内,被HAT结构域自动乙酰化 (autoacetylated)。其中一个乙酰化残基,acetyl-k1596,随后结合到分子内的bromodomain,抑制核小体的组蛋白H3乙酰化。这个结果令人惊讶:无序环 (disordered loop) 竟然可以通过分子机制调控组蛋白乙酰化!
该领域的更重要工作是将组蛋白翻译后修饰应用于治疗。"乙酰化在细胞中被精确地调控着,人们尝试通过乙酰转移酶抑制剂和bromodomain抑制剂操控它”,Wright博士说。乙酰转移酶和bromodomain能够读和写乙酰化标记,有望成为药物靶标。 “但首先我们需要更多地了解调控机制,以及如何操纵它”,Wright博士指出。
加利福尼亚大学神经生物学和行为学教授Marcelo A.Wood说,“整体的概念是,组蛋白去乙酰化酶复合物及其相关的共抑制物就像汽车上的分子刹车片 (molecular brake pad)”。在编码记忆信息的神经元中,这些分子刹车片处于接合状态,释放它们需要强有力的信号。Wood博士说,一旦释放它们,基因表达的改变可能会导致神经元的变化,从而导致行为的长期变化。
组蛋白与表观遗传
一些研究表明,表观遗传机制可以导致基因功能和表型的长期变化。表观遗传机制已知能影响细胞命运决定 (cell fate decisions),包括细胞记忆。Wood博士说:“我们推断,在神经元中,通过表观遗传机制的改变将导致可塑性和行为的长期变化。”
在早些时候,Wood博士团队证明在动物经历过阈下学习事件 (不会被编码为短期或长期记忆的学习活动) 后,抑制组蛋白去乙酰化酶 (HDAC),会恢复基因表达。这个启动信号让学习活动发生,从而形成牢固的长期记忆。“我们对所记的东西非常具有选择性,抑制HDAC可能是大脑是防止编码所有事情都变成记忆,”Wood博士说。
例如,虽然大多数人不记得几天之前的日常生活细节,但人们都会清楚地记得车祸发生的细节,包括地点、日期、时间、街道和汽车的颜色。Wood博士说:“这是因为应激激素释放立即切断了HDAC分子刹车片,让基因异常地表达,改变了神经元的可塑性。”正常情况下,HDAC抑制基因的表达,可能影响神经可塑性和长期记忆,但如果在HDAC“脱机”的情况下发生一个亚阈值学习事件,学习活动就会形成持久性记忆。
Wood博士说,“或许我们将这一机制应用于成瘾,通过接合消灭记忆的机制删除可卡因相关的记忆,并让HDAC‘下线‘使效果更持久。”
组蛋白乙酰化的作用
在20世纪70年代中期,科学家发现组蛋白在合成后立刻就被乙酰化了。特别是组蛋白H4乙酰化,是一个非常保守的模式;现在,赖氨酸5和12的双乙酰化被报道出现在所有检测过的真核生物中。组蛋白被包裹进染色质之后,残基就会去乙酰化。 ” Mark R. Parthun博士是俄亥俄州立大学的生物化学和药理学教授,在约20年前,他和同伴发现了这种乙酰化的酶。“人们一直试图找出这些分子乙酰化的原因,” Parthun博士说。大约20年前,他和同伴发现了这种乙酰化的酶。 “我们首先是在酵母中发现它的,然后注意到在去掉这种酶之后,酵母没有发育成一种表型。”缺失了表型,对这种酶的功能研究造成了困难,所以他们将研究转到更好的生化研究系统——小鼠模型上。
Parthun博士团队对野生型和无HAT1的突变小鼠胚胎细胞中新复制的染色质进行了定量蛋白质组学分析,发现没有HAT1的情况下,新生的染色质中没有了几种包含bromodomain的蛋白,这些蛋白包括了Brg1、Baz1A和Brd3,我们认为缺少了它们,会改变新生染色质的拓扑结构。
“我们的工作聚焦于细胞分裂过程中染色质的复制和继承,因此发明可以追踪染色质从首次复制开始到它成熟的动态过程的技术十分关键。”Parthun博士说。
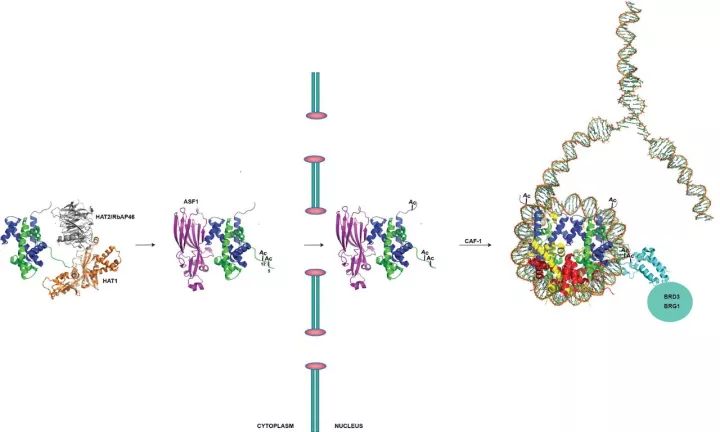
Multiple roles for histone acetyltransferase 1 in replication-coupledchromatin assembly.1
来自俄亥俄州立大学的Parthun研究团队已经确定了HAT1对复制耦合的染色质组装中的多种作用。例如,研究人员开发了一个HAT1如何在整个核进入和组蛋白沉积的过程中一直与H3、H4关联的模型。在这个模型中,BRG1和BRD3的bromodomain结合到新组装的组蛋白H4,帮助研究结构和新组装的染色质结构与拓扑学。
[1] Agudelo Garcia PA, et al.Identification of multiple roles forhistone acetyltransferase 1 inreplication-coupled chromatin assembly.Nucleic Acids Res. 2017 Sep19;45(16):9319-9335.
[2] HistoneModification at Core of Epigenetic Control. Genenpnews.com. 2017 Sep 1.
- - - 推荐阅读 - - -

Science | 增强子参与转录暂停/释放, 一个精致的调控机制
RNA聚合酶PolII参与基因转录时,有时会暂停在启动子下游,即启动子近端PolII暂停现象。来自美国西北大学的研究者早前已证明,negative elongation factor (NELF) 和DRB sensitivity-inducing factor (DSIF) 能阻止近端Pol II暂停,而Pol-II-associated factor 1 (PAF1) 能释放paused Pol II,继续转录延伸,合成RNA。
2017-09-16
Cell |转录调控新利器: 位点特异,远程互作,超级增强子,逐个CAPTURE!
基因表达依赖于顺式调控元件(CRE)和相关的反式作用因子。我们对蛋白编码基因了解得很多,而对顺式调控DNA了解得甚少,主要原因就是现有技术的限制:顺式调控DNA能与与蛋白和RNA复合物结合,通过远程染色质相互作用.
2017-09-08
新发现!不为人知的 “超级lncRNA”
来自美国休斯顿大学的研究者最近发现了一种靶向超级增强子的lncRNA,能促进超级增强子的染色质局部结构形成,所以他们将它命名为超级lncRNA (super-lncRNAs)。
2017-09-06
