Cell |转录调控新利器: 位点特异,远程互作,超级增强子,逐个CAPTURE!
基因表达依赖于顺式调控元件 (CRE) 和相关的反式作用因子。我们对蛋白编码基因了解得很多,而对顺式调控DNA了解得甚少,主要原因就是现有技术的限制:顺式调控DNA能与与蛋白和RNA复合物结合,通过远程染色质相互作用,形成三维结构。遗憾的是,我们提取单个调控序列的时候,往往无法区分特异性结合的调控因子和非特异的细胞物质。ChIP-seq依赖于单个调控因子或组蛋白修饰,但不能提取单个调控序列的结合复合物;LNA技术和TAL蛋白也只能提取多拷贝的基因组重复序列。
而在最近的一期Cell中,来自美国西南医学中心的研究者向我们展示了一种新的分离单一调控序列的方法——CAPTURE。
CAPTURE技术原理
CRISPR的核心元件包括Cas9和单向导RNA (sgRNA)。研究者设计了一个N端FLAG和生物素接头位点 (FB) 标签的无活性deactivated Cas9 (dCas9)。
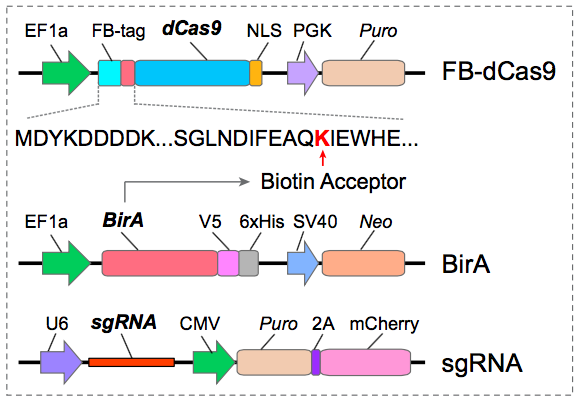
CAPTURE系统三个元件:FB-dCas9、生物素连接酶BirA,靶标特异性的sgRNA
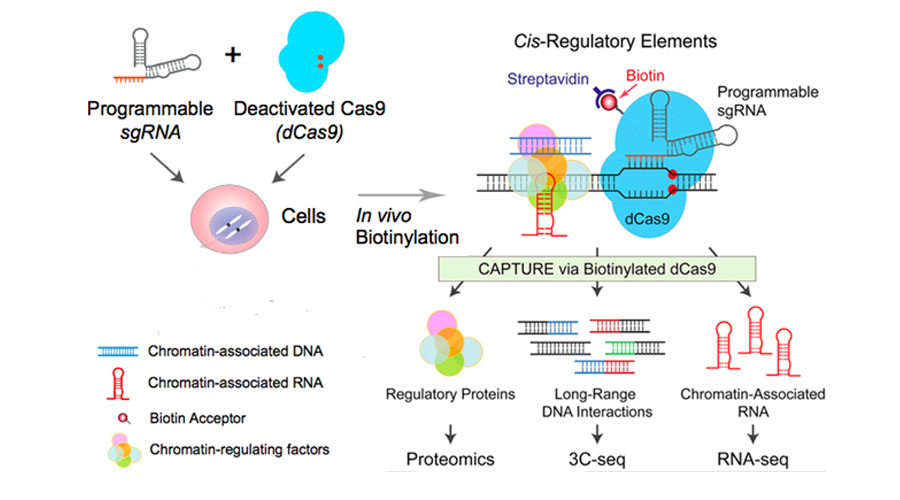
在体内用生物素连接酶BirA给dCas9标记上生物素,加上序列特异的sgRNA,高亲和链霉素就能分离纯化去基因组位点相关的大分子。提取到的蛋白,RNA和DNA复合物,分别用质谱和高通量测序研究native CRE调控蛋白、RNA和远程的DNA相互作用。
研究者将这项技术命名为CAPTURE (CRISPR affinity purification in situ of regulatory elements,CRISPR亲和纯化原位调控元件)。
这项技术有以下优点:
(1) 灵敏度高。生物素和链酶亲和素的亲和力 (affinity) 达到Kd = 10-14mol/L,是抗体介导的相互作用的1000倍以上,这样就可以更高效和更稳定地捕获蛋白—DNA复合物。
(2) 特异性高。这个方法没有使用抗体,能显著减少非特异性结合,此外,生物素—链霉亲和素出众的稳定性,利于进行严格的纯化过程,减少蛋白污染。
(3) 适用于多种方法。研究者可以改变sgRNA序列或组合来操纵dCas9 /sgRNA系统,那就可以作为研究染色质相互作用的高通量测序分析媒介。
于是研究者就开始利用CAPTURE做各种实验了。
通过β-Globin基因簇捕获实验,研究者证明CAPTURE-ChIP-seq可以鉴定出单拷贝的CRE,且CAPTURE系统对靶位点有着极高的特异性,适用于分离位点特异性的调控元件。
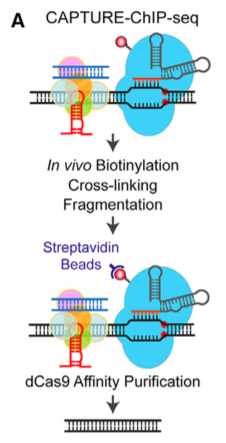
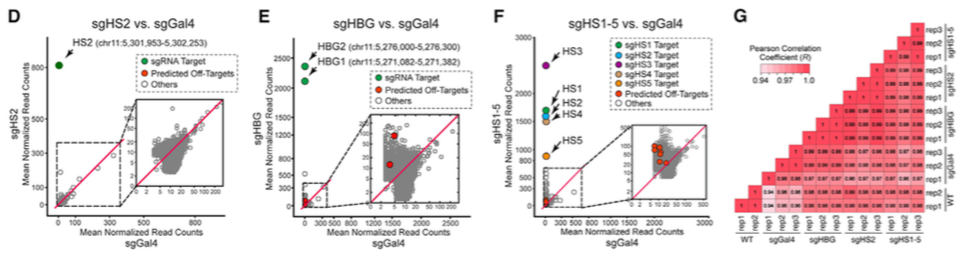
(D–F) Genome-wide differential analysis of dCas9 binding in cells expressing sgHS2,sgHBG, or sgHS1–5 versus sgGal4. (G) RNA-seq analysis was performed in cells expressing dCas9 with sgHS2, sgHBG,sgHS1–5, sgGal4, or WT K562 cells. (可点击图片,查看大图)
研究者还优化发明出CAPTURE-Proteomics,成功完成单个基因组位点的蛋白质分析:共表达带sgHS1-5的dCas9 (目的是富集球蛋白增强子所需的红系特异转录因子)、RNApolII和H2K27ac,再进行iTRAQ。结果在β球蛋白CRE上鉴定得许多已知因子,还在基因座控制区 (LCR) 增强子上发现新的相关复合物,包括核孔蛋白、大型多蛋白NPC元件。
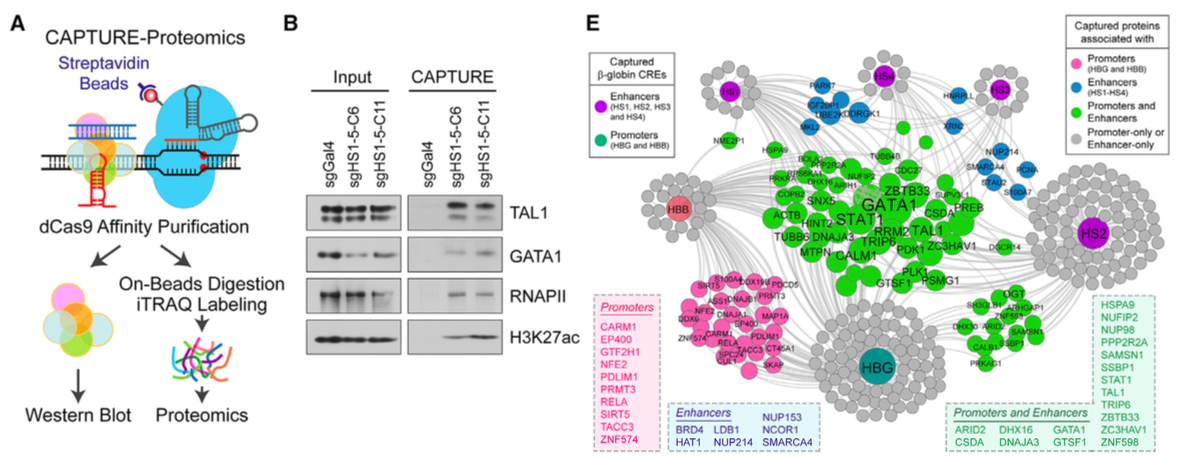
(A) Schematicof CAPTURE-Proteomics. (B) Western blot analysis of captured proteins in sgHS1–5 or sgGal4-expressing K562cells. (E) Connectivity network of CAPTURE-Proteomics-identified proteins converged byb-globin CREs.
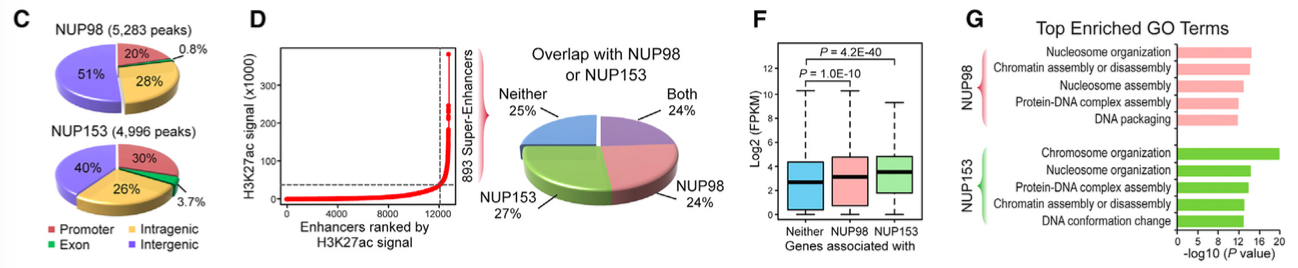
针对NUP98和NUP153进行ChIP-seq,在基因近端启动子和远端元件中分别找到5283个和4996个结合位点(C图),并且富集于红系SE(D图),与基因激活(F图)、核小体结构、DNA包装相关(G图)。
此CAPTURE-ChIP-seq实验表明NUP可能与线性TF以及染色质调控物体一起在基因转录时发挥作用;不仅发现了β球蛋白增强子的新调控因子,还证明了CAPTURE技术能在原位明确地鉴定蛋白复合物与一个单独的基因位点相关联的作用。
增强子可以通过远程DNA相互作用,调控远距离的特定的启动子。我们可以通过染色质构象捕获 (3C) 技术和衍生的技术4C、5C和Hi-C,还有FISH来检测远程的染色质相互作用。但是这三种方法或者需要预先知道染色质结构域,或者分辨率低,不能获得功能上的具体信息。对于远距离的染色质相互作用从头分析,可以使用ChIA-PET(配对末端标签测序分析染色质相互作用),可是这种技术依赖于特异的靶蛋白和抗体,所以不能应用于研究单一的基因位点。
于是,研究者将染色质相互作用实验与CAPTURE结合,无偏鉴定单一基因位点的远程相互作用:
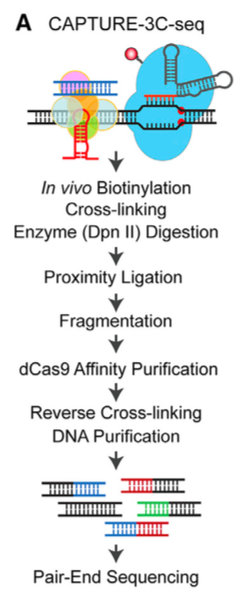
共表达dCas9和sgRNA,远程染色质相互作用,交联,DpnII消化,邻位连接近处的DNA片段,破碎之后,用dCas9捕获位点特异的相互作用,配对末端测序分析,检测远程相互作用。
研究者表示,这项技术无需预选择步骤如PCR扩增或者核酸捕获,所有相互作用都在一个实验中通过dCas9-tethered DNA捕获。那么效果如何呢?
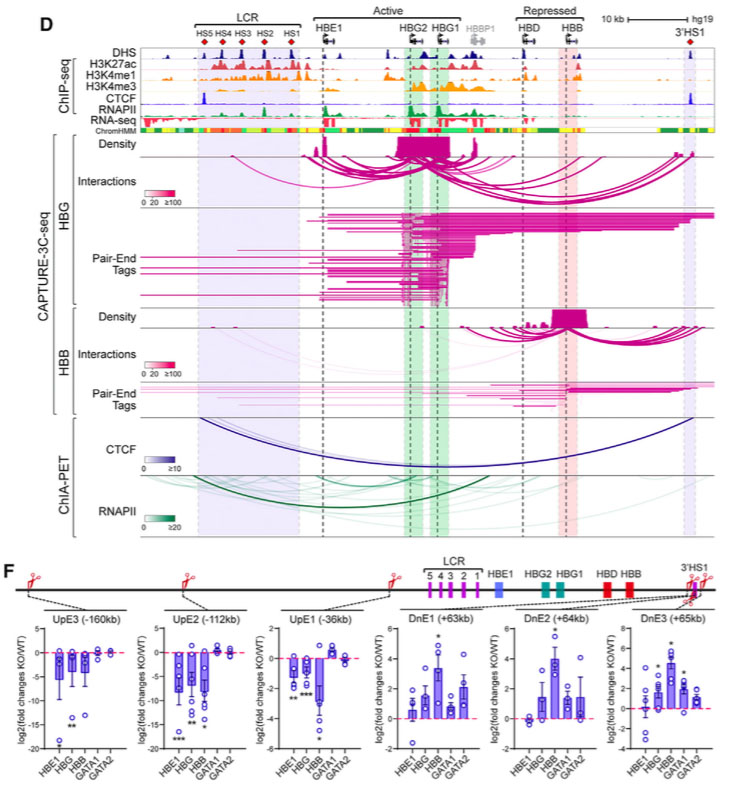
D.比较活跃的 (HBG) 和非活跃的 (HBB) 基因的远程相互作用,HBG的CAPTURE-3C-seq发现了215个与大部分β球蛋白GRE关联的远程相互作用,包括HS3、HBE1和3’HS1,而在HBB中没有发现。F. 利用配对的sgRNA,进行CPISPR敲除,位于HBE1上游160kb处的UpE3元件被删除了,导致β球蛋白基因下调。
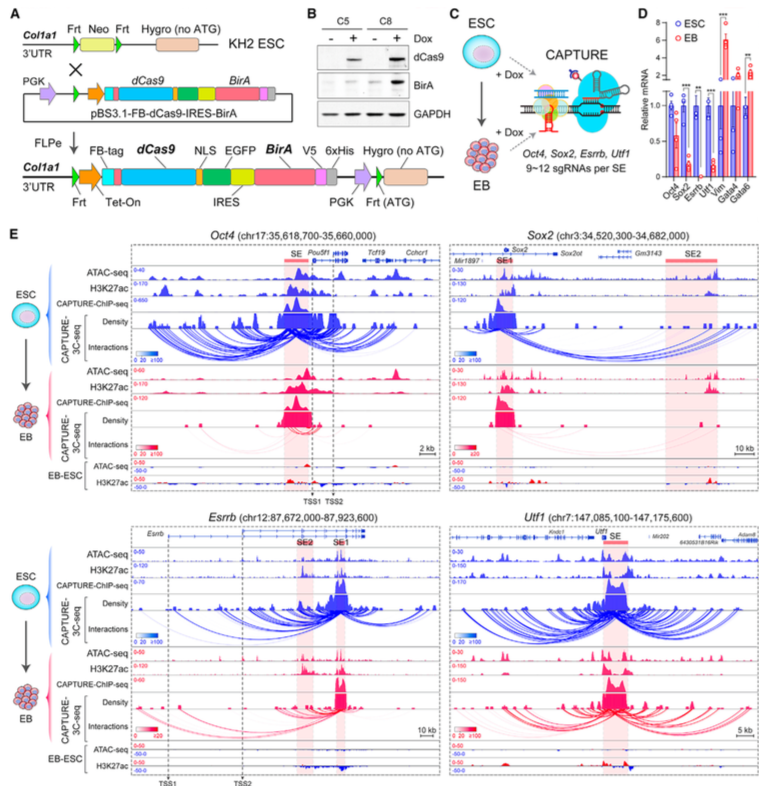
为了证明CAPTURE可以跨细胞模型运用,研究者分析了小鼠胚胎干细胞ESC分化过程中品系特异的超级增强子。通过FLPe介导的结合,研究者敲进了FB-dCas9-EGFP和BirA (图A),多西环素可诱导dCas9和BirA蛋白表达 (图B)。ESC分化为类胚体。研究者设计了靶向4个ESC特异的超级增强子的sgRNA (图C)。在分化的时候,超级增强子关联的基因显著地下调了 (图D)。用针对各个超级增强子的CAPTURE分析其相关的远程相互作用和染色质特征 (图E),发现在ESC中,超级增强子和它们靶基因间的有着很频繁的远程互作,但在类胚体中显著减少甚至没有了。
此实验证明,CAPTURE技术可以在人类细胞和转基因小鼠ESC细胞中高效应用。
原文:Liu, et al. In Situ Capture of Chromatin Interactions by Biotinylated dCas9. Cell 170, 1028–1043 (2017).
Epi老师:已知顺式调控元件,寻找相互作用的未知反式作用因子,是一个难题。用生物素标记的dCas9,能够找到位点特异性的DNA-蛋白相互作用,着实令人兴奋!不过,CAPTURE作为一项新技术,仍存在一些不足,比如需要的细胞样本量较大,每次实验需0.25~1 ×109个细胞。希望研究者能进一步完善CAPTURE技术,解决实际操作瓶颈,给各位基因转录调控研究者带来一项研究利器。
- - - 推荐阅读 - - -
新发现!不为人知的 “超级lncRNA”
来自美国休斯顿大学的研究者最近发现了一种靶向超级增强子的lncRNA,能促进超级增强子的染色质局部结构形成,所以他们将它命名为超级lncRNA (super-lncRNAs)。
2017-09-06

转载 | SCI论文的构思
SCI论文从入门到精通 一、先想先写最后做: 1.做研究之前,必须想清楚:结果能不能发表?发表在哪里? 2.先把文章大框写好,空出数据,等做完实验填完空就可以发了;正所谓心中
2017-09-02
Epiview深度解读 | Science : circRNA在大脑中的潜在功能!
当RNA咬住了自己的尾巴,变身环形RNA(circularRNA,以下简称circRNA)之后,会有怎样特殊的功能呢?
2017-08-28
