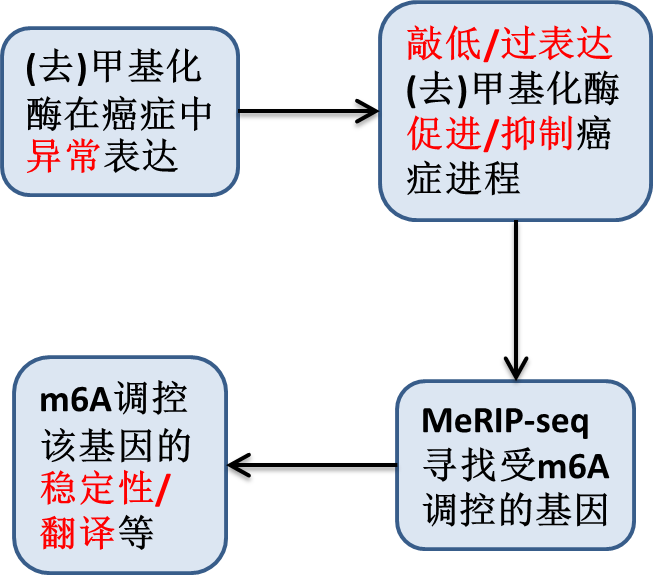
m6A正火,ac4C又至!详解Cell最新ac4C研究
表观转录组(epitranscriptome)可谓近年来最火热的研究领域。其中,m6A也成为仅凭一己之力,带动整个领域发展的最具价值研究对象!
早在1974年,Desrosiers[1]和Perry &Kelley[2]课题组分别同时在mRNA上鉴定到m6A修饰,而此后,m6A处于无人问津的状态。
2010年-2012年间,m6A的甲基化酶METTL3[3]和去甲基化酶FTO[4]被鉴定,并且基于抗体富集m6A阳性RNA的测序方法(MeRIP-Seq)的产生[5],人们意识到:
1. m6A是一个可逆的,受到动态调控的RNA修饰。
2. RNA上的m6A是可通过测序方法精确鉴定的。
因此,m6A逐渐受到越来越多的关注,其强大的功能也不负众望!
m6A在癌症中的研究套路:表达→表型→测序→功能,已成功帮助它登上Cell Stem Cell, Cancer Cell, Nature Cell Biology 等一系列高水平杂志,癌症类型覆盖白血病,神经胶质瘤,乳腺癌,肝癌和肺癌等。
看到这里,小伙伴们是不是羡慕这种简单粗暴又高效的研究对象和方法。

然而是不是也后悔没早些加入这样前沿的研究领域。

没关系!今日小编带来RNA ac4C的研究解析,
这可是表观转录组研究的“超级潜力股”!
ac4C在mRNA上的功能可谓一出道即达巅峰!
2018年12月13日,美国NIH的Shalini Oberdoerffer教授在CELL发表研究:Acetylation of Cytidine in mRNA Promotes Translation Efficiency,该研究首次揭示mRNA上存在大量ac4C修饰,并且ac4C影响mRNA的稳定性与翻译效率。
目前已鉴定到的核糖核苷修饰已超过140种,大量研究集中在tRNA和rRNA上,而mRNA上的化学修饰及其作用,研究尚处起步阶段。(主要是因为根据中心法则,DNA-RNA-蛋白,mRNA仅仅是“信使”的作用,代谢快,半衰期短,早期未曾想到mRNA的化学修饰能对基因表达起到如此重要的作用!)
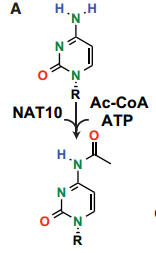
N4-acetylcytidine (ac4C),N4位乙酰胞嘧啶,是真核原核生物中保守的化学修饰,早期研究认为ac4C主要存在tRNA和18S rRNA上。而近期研究显示,mRNA上也存在大量的ac4C,其丰度甚至不低于mRNA携带的m7G帽子修饰[6,7]。NAT10是目前鉴定的唯一同时具有乙酰化酶结构域和RNA结合结构域的蛋白,因此被认为是RNA ac4C修饰酶。
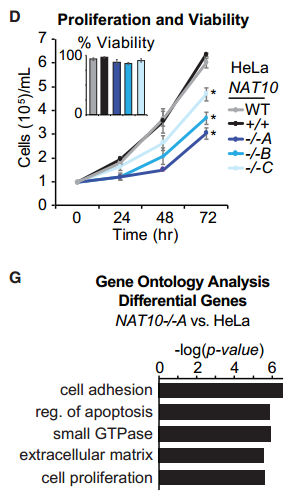
研究者利用CRISPR技术在HELA细胞中敲低NAT10,发现细胞增殖被抑制,RNA-seq分析显示大量与细胞生长相关的基因下调表达。
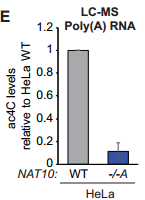
那么,NAT10是否通过影响mRNA上的ac4C修饰抑制细胞增殖呢?通过分离带polyA 的mRNA,研究者证实mRNA上确实存在大量ac4C修饰,并且敲低NAT10后,ac4C显著降低,提示NAT10可能通过影响mRNA ac4C修饰发挥癌基因的作用。

ac4C发挥了什么功能呢?研究者首先通过acRIP-seq的方法,发现ac4C主要富集在CDS区,另5’UTR和3’UTR区也有分布。
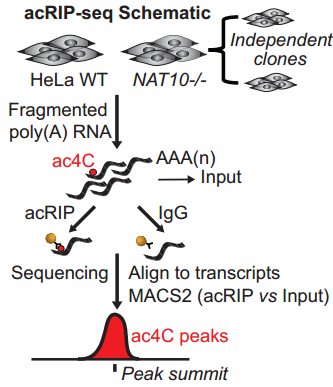
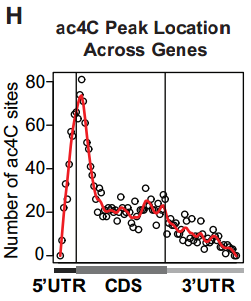
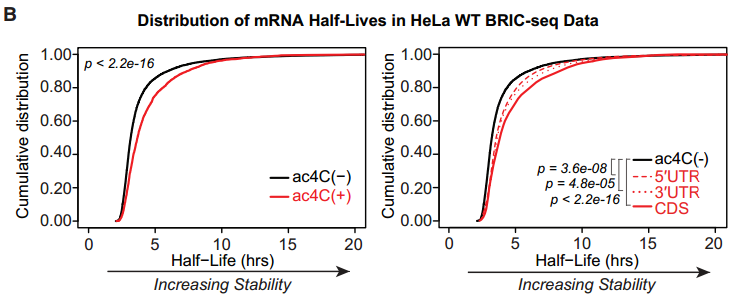
考虑到敲低NAT10后引起了大量增殖相关基因mRNA的变化,研究者首先推测ac4C影响mRNA的稳定性。确实,富集ac4C的mRNA拥有更长的半衰期,提示它们的稳定性更高。
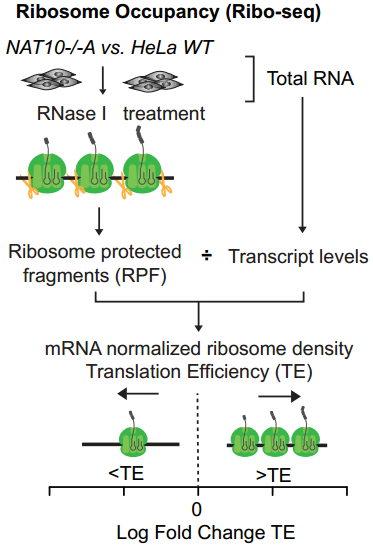
mRNA的稳定性与翻译效率息息相关,通常翻译效率高的mRNA更稳定,而翻译效率低的mRNA会很快被降解[8]。因此,研究者进一步想知道,ac4C是否影响了mRNA的翻译效率。通过ribo-seq,研究者发现携带ac4C的mRNA翻译效率(Translation Efficiency,TE)更高。

总的来说,该研究首次证明ac4C修饰对mRNA的命运决定(稳定性和翻译)至关重要,成为ac4C在表观转录组研究的开山之作。
但同时我们也应意识到,虽然登上Cell,该领域的研究还有很多待解决的问题。识别并介导ac4C mRNA的稳定性和翻译效率的蛋白是什么,也就是ac4C的阅读器(reader)有哪些?ac4C对mRNA的选择性是如何实现的?ac4C与其他RNA修饰,比如m6A,或组蛋白修饰,比如H3K4等,是否存在cross talk,其生理意义是什么?
更为重要的是,ac4C在癌症进程中扮演了什么角色?NAT10,作为ac4C唯一的乙酰化酶,它在癌症中的表达和作用能提示mRNA ac4C的功能。实际上,目前关于NAT10的研究,我们在pubmed上仅能搜到37项,提示NAT10的研究空间很大。并且,这些研究提示NAT10在多种癌症中高表达,包括肝癌,骨肉瘤和白血病等。而关于NAT10的作用机制研究还非常有限,集中在NAT10对p53乙酰化的影响上,尚未有将NAT10在癌症中的作用与mRNA ac4C联系起来。因此我们可以看出,关于ac4C在癌症中的作用研究,是一个非常有潜力的方向。
那么问题来了,如何开展ac4C在癌症中的功能研究呢?参考m6A的研究套路,首先需要转录组数据(TCGA和Oncomine等数据库),分析NAT10在所研究的癌症体系中是否异常表达(高表达或低表达),然后利用NAT蛋白抑制剂、siRNA或者CRISPR的方法敲低或敲除NAT10,一系列表型检测(增殖,凋亡,转移,侵袭和自我更新能力等),再通过acRIP-seq鉴定发生ac4C变化的mRNA,分析ac4C如何影响靶基因的变化。
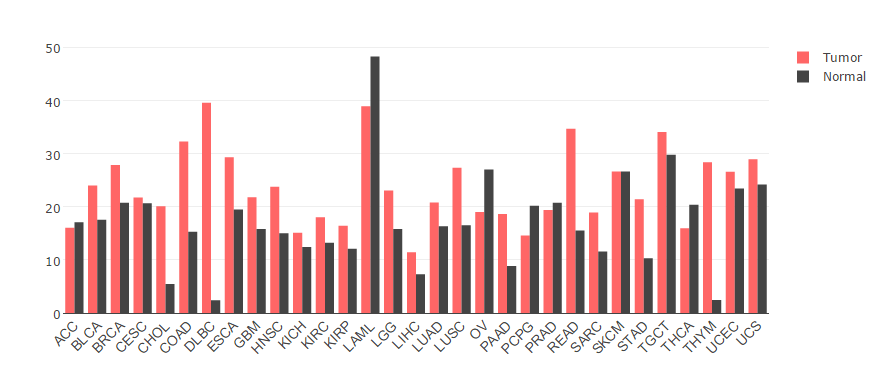
图:通过TCGA泛癌数据分析,NAT10基因在大部分肿瘤中异常高表达
数据来源:http://gepia.cancer-pku.cn/detail.php?gene=NAT10
广州表观生物科技有限公司紧跟领域研究前沿,注重技术的革新开发,通过与国外抗体品牌公司合作开发ac4C定制化抗体,结合最新的微量RIP-seq技术,成功开发acRIP-seq的商品化服务,助力您的表观遗传学研究!
图A为表观生物实测的acRIP-seq数据motif分析结果,与图B的Cell文章结果完美一致。

图A. 表观实测数据motif分析结果

图B. 已发表论文结果[9]
欢迎拨打400-775-0875或点击本页面右侧【在线咨询】了解acRIP-seq!
参考文献
1. Desrosiers R, Friderici K, Rottman F.1974. Identification of methylated nucleosides in messenger RNA from Novikoffhepatoma cells. PNAS 71:3971–75
2. Perry RP, Kelley DE. 1974. Existence ofmethylated messenger RNA in mouse L cells. Cell 1:37–42
3. Agarwala SD, Blitzblau HG, Hochwagen A,Fink GR. 2012. RNA methylation by the MIS complex regulates a cell fatedecision in yeast. PLOS Genet. 8:e1002732
4. Jia G, Fu Y, Zhao X, Dai Q, Zheng G, etal. 2011. N6-Methyladenosine in nuclear RNA is a major substrate of theobesity-associated FTO. Nat. Chem. Biol. 7:885–87
5. Meyer KD, Jaffrey SR. 2014. The dynamicepitranscriptome: N6-methyladenosine and gene expression control. Nat. Rev.Mol. Cell Biol. 15:313–26
6. Dong, C., Niu, L., Song, W., Xiong, X.,Zhang, X., Zhang, Z., Yang, Y., Yi, F.,Zhan, J., Zhang, H., et al. (2016). tRNAmodification profiles of the fast-proliferating cancer cells. Biochem. Biophys.Res. Commun. 476, 340–345.
7. Castello, A., Fischer, B., Eichelbaum,K., Horos, R., Beckmann, B.M., Strein,C., Davey, N.E., Humphreys, D.T., Preiss,T., Steinmetz, L.M., et al. (2012). Insights into RNA biology from an atlas ofmammalian mRNA-binding proteins.Cell 149, 1393–1406.
8. Hanson, G., and Coller, J. (2018). Codonoptimality, bias and usage in translation and mRNA decay. Nat. Rev. Mol. CellBiol. 19, 20–30.
9. Arango D, Sturgill D, Alhusaini N, et al. Acetylation of cytidine in mRNA promotes translation efficiency[J]. Cell, 2018, 175(7): 1872-1886. e24.
- - - 推荐阅读 - - -

年度大盘点| 2018外泌体重量级研究一览,看这篇就够了
年度大盘点|2018外泌体重量级研究一览,看这篇就够了 原创:Epi老师表观生物 刚过去的2018年,也是外泌体研究热度持续升温的一年,在多个领域均涌现了重大的研究进展。久等了!2018外泌体研究盘点
2019-02-26
专家解读Cell丨mRNA乙酰化修饰的重要发现与生物学意义
解读丨李笑雨、伊成器(北京大学生命科学学院) 责编丨迦溆 当前研究已经在RNA上发现了超过100种不同类型的转录后修饰【1】,这些修饰大部分分布在rRNA、tRNA等高丰度的ncRNA上,并且对这
2019-02-16
最新发布| 国家重点研发计划“干细胞及转化研究”立项超1/4与表观遗传机制相关
国家重点研发计划“干细胞及转化研究”重点专项2018年度拟立项项目信息已于今天公示,拟立项项目共计30项。 根据《国务院关于改进加强中央财政科研项目和资金管理的若干意见》(国发[2014]11号)、《国务院
2018-06-04
